
|
|
강의 요약, 유아용 침대
무기화학. 치트 시트: 간략하게, 가장 중요한
차례
1. 신체의 신진 대사 과정과 에너지 사이의 관계. 열역학 시스템 지구상의 생명 과정은 주로 생체 물질(단백질, 지방, 탄수화물)에 태양 에너지가 축적되고 에너지 방출과 함께 살아있는 유기체에서 이러한 물질이 변형되기 때문입니다. A. M. Lavoisier(1743-1794)와 P. S. Laplace(1749-1827)의 연구는 일생 동안 방출되는 에너지가 동물이 흡입한 공기 중의 산소에 의한 식품의 산화에 의해 결정된다는 직접적인 열량 측정을 통해 보여주었습니다. XIX-XX 세기의 발전과 함께. 열역학을 통해 생화학 반응에서 에너지 전환을 정량적으로 계산하고 그 방향을 예측할 수 있게 되었습니다. 열역학적 방법은 "시스템", "시스템 상태", "시스템의 내부 에너지", "시스템 상태의 기능"과 같은 여러 엄격한 개념을 기반으로 합니다. 열역학 시스템 자연의 모든 대상은 충분히 많은 수의 분자(구조 단위)로 구성되고 실제 또는 가상의 경계면(인터페이스)에 의해 자연의 다른 대상과 분리되어 있습니다. 시스템에 포함되지 않은 자연의 대상을 환경이라고 합니다. 시스템의 가장 일반적인 특성은 m - 시스템에 포함된 물질의 질량과 E - 시스템의 내부 에너지입니다. 시스템 물질의 질량은 시스템을 구성하는 분자의 총 질량에 의해 결정됩니다. 시스템의 내부 에너지는 분자의 열 운동 에너지와 이들 사이의 상호 작용 에너지의 합입니다. 환경과 물질 및 에너지 교환의 특성에 따라 시스템은 격리, 폐쇄 및 개방의 세 가지 유형으로 나뉩니다. 고립된 시스템 매질과 물질이나 에너지를 교환하지 않는 시스템을 호출합니다(Δm = 0, ΔE = 0). 닫힌 시스템은 환경과 물질을 교환하지 않지만 에너지를 교환할 수 있는 시스템입니다(Δm = 0, ΔE^ 0). 에너지 교환은 열을 전달하거나 작업을 수행하여 수행할 수 있습니다. 개방형 시스템 이러한 시스템은 매질과 물질과 에너지를 모두 교환할 수 있는 시스템이라고 합니다(Δm ≠ 0, ΔE ≠ 0). 개방형 시스템의 중요한 예는 살아있는 세포입니다. 시스템은 구성되는 물질의 응집 상태에 따라 동종 및 이종으로 나뉩니다. 균질 시스템에서는 시스템의 한 영역에서 다른 영역으로 이동할 때 물리적 및 화학적 특성에 급격한 변화가 없습니다. 이러한 시스템의 예는 다양한 생체 물질의 용액인 혈장입니다. 이기종 시스템은 둘 이상의 동종 부품으로 구성됩니다. 이종 시스템의 예는 전혈, 즉 적혈구 및 백혈구와 같은 세포가 있는 혈장입니다. 2. 열역학 제XNUMX법칙. 시스템을 특징짓는 개념 열역학 제XNUMX법칙은 다양한 시스템의 에너지를 분석하기 위한 엄격한 정량적 틀을 제공합니다. 이를 공식화하려면 시스템을 특징짓는 여러 가지 새로운 개념을 도입해야 합니다. 가장 중요한 개념 중 하나는 시스템의 상태입니다. 상태는 열역학의 관점에서 시스템을 정의하는 것을 가능하게 하는 시스템 속성 세트로 이해됩니다. 시스템 상태의 일반화 된 특성으로 "평형", "정지", "과도기 상태"라는 개념이 사용됩니다. 모든 속성이 장기간 일정하게 유지되고 시스템에 물질과 에너지의 흐름이 없는 경우 시스템의 상태를 평형이라고 합니다. 시스템의 속성은 시간에 따라 일정하지만 물질과 에너지의 흐름이 있는 경우 상태를 정지 상태라고 합니다. 정량적으로 상태는 열역학적 변수의 도움으로 구별됩니다. 열역학적 변수는 시스템 전체의 상태를 특징짓는 양입니다. 시스템의 열역학적 매개변수라고도 합니다. 가장 중요한 열역학적 변수는 압력 p, 온도 T, 시스템의 부피 V 또는 시스템의 총 질량 m, 시스템을 구성하는 화학 물질(구성 요소)의 질량 mk 또는 이러한 물질의 농도 m입니다. 유사한 특성 (온도, 체중, 체액 구성, 혈압)이 의사가 환자의 상태를 결정하는 데 사용된다는 점에 유의해야합니다. 시스템이 한 상태에서 다른 상태로 전환되는 것을 프로세스. 프로세스의 결과로 시스템의 상태와 열역학적 변수가 변경됩니다. 초기 상태에서 열역학적 변수의 값을 Х로 표시하면1 , 그리고 마지막으로 - X2 , 이 변수의 변화는 각각 ΔX = X와 같습니다.2 - 엑스1 열역학적 변수 X의 증분이라고 합니다. 반대 부호로 취한 증분을 변수 X의 감소라고 합니다. 시스템 E의 내부 에너지는 열역학적 상태 함수 중 하나입니다. 상태 기능의 중요한 특징은 주어진 시스템 상태를 달성하는 방법으로부터의 독립성입니다. 시스템의 내부 에너지 변화 ΔE는 시스템과 환경의 상호 작용 중에 수행되는 일 W와 환경과 시스템 간의 열 교환 Q로 인한 것이며 이러한 양 사이의 비율은 다음과 같습니다. 열역학 제XNUMX법칙의 내용. 어떤 과정에서 계의 내부 에너지의 증가 ΔE는 계가 받는 열 Q에 이 과정에서 계에 한 일 W를 더한 것과 같습니다.: ∆E=Q+W. 생물학적 시스템에서 열은 일반적으로 시스템에 의해 외부 환경으로 방출되고 내부 에너지의 손실로 인해 시스템에 의해 작업이 수행됩니다. 열역학 제XNUMX법칙의 수학적 기록을 다음과 같은 형식으로 표현하는 것이 편리합니다. ∆E = Q - W. 위 공식의 모든 양은 줄(J)로 측정됩니다. 3. 열역학 제XNUMX법칙 열역학 제XNUMX법칙은 다른 어떤 법칙에서도 도출할 수 없는 자연의 기본 법칙 중 하나이다. 그 타당성은 수많은 실험, 특히 외부에서 에너지를 공급하지 않고 임의의 시간 동안 임의의 시간 동안 작업을 수행할 수 있는 XNUMX종 영구 운동 기계를 구축하려는 시도에 실패한 시도에 의해 입증되었습니다. 시스템의 프로세스 조건에 따라 열역학 제XNUMX법칙에서 파생된 다양한 상태 함수가 사용됩니다. 동시에 복잡한 생물학적 시스템 대신 단순화 된 모델을 사용하여 질량과 에너지의 변환에 대한 결론을 얻습니다. 시스템의 압력은 일정하게 유지되며 외부 압력과 같습니다. p = const에서 발생하는 이러한 프로세스를 등압이라고 합니다. 등압 과정에서 수행되는 확장 작업은 다음과 같이 알려져 있습니다. W = ρΔV, 여기서 ΔV는 시스템의 부피 증분으로 상태 2와 1의 부피 차이와 같습니다. 확장 작업을 첫 번째 법칙의 수학적 표현으로 대체하고 간단한 변환을 수행하면 다음을 얻습니다. Qρ = ΔE + pΔV = (E2 + ρV2)-(이자형1 +ρΔV1) 여기서 Qρ는 등압 과정의 열입니다. 1, 2 - 프로세스의 시작과 끝과 관련된 인덱스. 값(E + pV)은 H로 표시되고 엔탈피라고 하는 시스템 상태의 함수입니다. H = E + ρV. 따라서 표현식은 다음과 같이 쓸 수 있습니다. Qp = H2 - 시간1 = ∆H. 이 식으로부터 다음과 같이 된다. 엔탈피 - 상태 함수, 증분은 등압 과정에서 시스템이 받는 열과 같습니다. 일정한 압력에서 열량계에서 이 과정을 수행함으로써 특정 과정에서 엔탈피 증가의 측정을 수행할 수 있습니다. 이것이 A. M. Lavoisier와 P. S. Laplace가 살아있는 유기체의 신진 대사 에너지를 연구하는 실험을 수행 한 방법입니다. 시스템 상태의 변화가 일정한 볼륨에서 발생하는 경우 프로세스를 등코릭이라고 합니다. 이 경우 부피 변화 AV는 0이고 공식에 따라 팽창 작업 W = XNUMX입니다. 그런 다음 열역학 제XNUMX법칙의 수학적 표현에서 다음을 따릅니다. Qv = ∆E. 열역학적 정의는 위의 관계식에서 따릅니다. 내부 에너지 - 상태 함수, 증분은 등각선 과정에서 시스템에 의해 얻은 열 QV와 같습니다. 따라서 일정한 부피의 열량계에서 이 과정을 수행하여 특정 과정에서 내부 에너지의 변화를 측정할 수 있습니다. ρ = const에서 내부 에너지와 엔탈피의 증분은 다음 관계식에 의해 관련됩니다. ∆H = ∆E + ρ∆V. 4. 헤스의 법칙 화학 반응에서 에너지의 변환을 연구하는 열역학 섹션을 화학 열역학이라고 합니다. 내부 에너지 ΔE, 엔탈피 ΔH 또는 이 반응에 해당하는 다른 상태 함수의 변화가 표시되는 반응 방정식을 열화학이라고 합니다. 계의 엔탈피가 감소하고(ΔH < 0) 열이 외부 환경으로 방출되는 화학 반응을 발열. 엔탈피가 증가하고(ΔH > 0) 시스템이 열을 흡수하는 반응 Qp 외부는 호출 흡열. 산소에 의한 포도당의 산화는 많은 양의 열 방출(Qp \u2800d XNUMX kJ / / mol), 즉 이 과정은 발열입니다. 해당 열화학 방정식은 다음과 같이 쓸 수 있습니다. С6 Н12 О6 + 602 = 6С02 + 6시간2아, ΔH = 2800kJ. 용액에서 일어나는 반응은 일반적으로 시스템 부피의 약간의 변화, 즉 ΔV ≈ 0을 동반합니다. 이와 관련하여 많은 경우 생물학적 계산에서 ΔH = ΔE라고 가정할 수 있습니다. 결과적으로 이러한 시스템에서 열 방출은 주로 반응의 결과로 인한 내부 에너지 감소로 인한 것이며 그 반대의 경우도 마찬가지입니다. 화합물 A의 형성 엔탈피는 시스템 엔탈피의 변화 ΔHA 단순한 물질로부터 1 mol의 화합물 A의 형성을 수반한다. 산소, 탄소, 수소 및 기타 모든 원소(단순한) 물질의 형성 엔탈피는 XNUMX으로 가정합니다. 다른 조건이 동일하면 내부 에너지와 엔탈피는 시스템의 물질 양에 비례합니다. 이러한 열역학 함수를 확장이라고 합니다. 열역학의 관점에서 일반적인 형태 n의 반응A에이 + 피В = nС + 엔D , Δh는 엔탈피 H가 있는 초기 상태에서 시스템의 전이입니다.1 엔탈피 H가 있는 상태 22. 이 반응의 엔탈피라고하는이 전환의 결과로 시스템의 엔탈피 변화는 차이와 같습니다. △H피아 = H2 - 시간1 = (ncHc + 엔DHD) - (NАНА + 엔BHB). 열 합 불변의 법칙은 1840년 러시아 화학자 G. I. Hess에 의해 발견되었습니다. 그는 화학 변형에서 열역학 제XNUMX법칙의 적용 가능성을 발견한 사람이자 화학 열역학의 창시자입니다. 현재 Hess의 법칙은 열역학 제XNUMX법칙의 결과로 간주되며 다음과 같이 공식화됩니다. 일정한 압력에서 주어진 시약으로부터 주어진 생성물 형성의 엔탈피 증가는 형성을 초래하는 반응의 수와 유형에 의존하지 않습니다 이 제품의. 열화학적 계산에서 헤스 법칙 자체가 더 자주 사용되는 것이 아니라 등식 형태의 포도당 산화의 특정 경우에 대해 위에서 파생된 결과입니다(2). 일반 형태 p로 제시된 반응의 경우А에이 + 피вB = = nсC + 엔DD, 헤스 법칙의 결과는 등식 ΔH를 사용하여 작성됩니다.피아 = (nC△HC + 엔D△HD) - (NA△HA ++nB△HB ) 및 다음과 같이 공식화됩니다. 반응 엔탈피는 화학량론적 양의 생성물 형성 엔탈피의 대수적 합에서 화학량론적 양의 반응물 형성 엔탈피의 대수적 합을 뺀 것과 같습니다. 5. 열역학 제XNUMX법칙. 깁스의 자유 에너지 신체는 구성 물질의 원자의 화학적 상호 작용 에너지 형태로 저장된 내부 에너지를 소비하여 작업을 수행합니다. 열역학 제 XNUMX 법칙의 수학적 표현 ΔE \uXNUMXd Q - W는 시스템의 내부 에너지 소비 ΔЕ, 시스템이 수행하는 작업 W 및 다음과 같은 형태로 손실되는 에너지 Q 사이의 정확한 관계를 결정합니다. 열. 그러나 열역학 제XNUMX법칙에 따르면 소비된 내부 에너지 중 일로 변환할 수 있는 부분을 결정하는 것은 불가능합니다. 이론적 비용 추정은 열역학 제XNUMX법칙을 기반으로 합니다. 이 법은 에너지를 일로 변환하는 효율성에 대해 엄격한 제한을 부과하며, 또한 프로세스의 자발적 흐름 가능성에 대한 기준을 도입할 수 있습니다. 프로세스라고 합니다 자발적인아무런 영향 없이 수행된다면, 시스템은 그 자체로 남겨질 때. 시스템의 내부 에너지가 변하지 않는 과정이 있습니다(ΔE = 0). 이러한 공정에는 예를 들어 물에서 아세트산의 이온화가 포함됩니다. 내부 에너지의 증가(ΔE > 0)와 함께 많은 자발적 과정이 진행됩니다. 여기에는 특히 Cu와 같은 금속 이온과 알부민(혈장 단백질)의 생체 무기 화합물 형성의 전형적인 반응이 포함됩니다.2+. 폐쇄 시스템에 대한 내부 에너지 AE의 변화는 자발적 과정에 대한 기준이 될 수 없습니다. 결과적으로, 이 기준이 파생된 열역학 제XNUMX법칙은 프로세스의 효율성뿐만 아니라 자발성의 문제를 해결하기에 충분하지 않습니다. 이러한 질문의 해결책은 열역학 제XNUMX법칙의 도움으로 이루어집니다. 열역학 제XNUMX법칙을 공식화하려면 열역학적 의미에서 가역 및 비가역 과정의 개념을 도입할 필요가 있습니다. 시스템이 평형 상태에 있으면 이 상태는 동일한 외부 조건에서 무한정 유지됩니다. 외부 조건이 변경되면 시스템의 상태가 변경될 수 있습니다. 즉, 시스템에서 프로세스가 발생할 수 있습니다. 초기 상태 1에서 최종 상태 2로 전환하는 동안 모든 중간 상태가 평형 상태에 있는 경우 프로세스를 열역학적으로 가역적이라고 합니다. 중간 상태 중 적어도 하나가 비평형인 경우 프로세스를 열역학적으로 비가역적이라고 합니다. 가역 프로세스는 온도, 압력, 물질 농도 등 시스템 매개변수의 변화가 충분히 느린 경우에만 수행할 수 있습니다. 매개변수의 변화율은 프로세스 중에 발생하는 평형 편차와 같아야 합니다. 무시할 수 있습니다. 의학에서 중요한 문제는 가역성, 즉 저온에서 조직을 보존하는 것과 관련되어 있다는 점에 유의해야 합니다. 가역적 프로세스는 자연에서 발생하고 산업 또는 실험실에서 수행되는 실제 프로세스의 제한적인 경우입니다. 6. 열역학 제XNUMX법칙. 엔트로피 최대 작업 Wмакс상태 1에서 상태 2로의 전이 과정에서 주어진 내부 에너지 ΔE의 손실로 얻을 수 있는 는 이 과정이 가역적일 경우에만 달성됩니다. 열역학 제XNUMX법칙에 대한 표현에 따르면, 최소 열 Q분 Q분 \uXNUMXd ΔE - Wмакс . 시스템 내부 에너지의 비용 효율성을 특징짓는 최대 달성 가능한 효율성 계수는 각각 다음과 같습니다. ηмакс= 여макс / ΔE. 상태 1에서 상태 2로의 비가역적 전환 과정에서 시스템이 수행한 일은 W보다 적습니다. 최대 계수 h를 계산하려면макс 알려진 값 ΔE로 W 값을 알아야 합니다.макс 또는 Q분 Wмакс = ΔE - Q분 , 따라서, ηмакс \u1d XNUMX-ΔE / Q분 . Q 값분 엔트로피라는 열역학 상태 함수를 사용하여 열역학 제XNUMX법칙에서 계산할 수 있습니다. 엔트로피의 개념은 열역학 및 열 과정의 분자 운동 이론의 창시자 중 한 명인 독일 물리학자 R. Yu. Clausius(1865-1822)에 의해 1888년에 소개되었습니다. Clausius에 따른 엔트로피의 열역학적 정의: 엔트로피는 증분 ΔS가 열 Q와 같은 상태 함수입니다.분 가역적 등온 공정으로 시스템에 가져온 값을 공정이 수행되는 절대 온도 T로 나눈 값: ∆S = Q분 / 티 엔트로피 단위가 J/K라는 공식을 따릅니다. 가역 등온 과정의 예는 273°K의 물로 채워진 보온병에서 얼음이 천천히 녹는 것입니다. 1몰의 얼음(18g)을 녹이려면 최소 6000J의 열을 공급해야 한다는 것이 실험적으로 입증되었습니다. 이 경우, 보온병에서 "얼음-물" 시스템의 엔트로피는 ΔS = 6000 J: 273°K = 22 J/K만큼 증가합니다. 물이 담긴 보온병을 273°K로 냉각하면 6000J의 열을 천천히 제거할 수 있으며 물이 결정화되는 동안 1몰의 얼음이 생성됩니다. 이 과정에서 Q분 수식에서 음수입니다. 따라서 1몰의 얼음이 형성되는 동안 "얼음-물" 시스템의 엔트로피는 ΔS = 22 J/K만큼 감소합니다. 유사하게, 이러한 과정 동안 시스템에 공급되거나 시스템에서 제거된 열이 알려진 경우 모든 등온 물리적 및 화학적 프로세스에 대한 엔트로피의 변화를 계산하는 것이 가능합니다. 물리학에서 알 수 있듯이 이 열은 열량 측정을 사용하여 결정할 수 있습니다. 따라서 엔트로피의 변화와 시스템 상태의 다른 두 가지 기능인 내부 에너지와 엔탈피는 실험적으로 결정된 양입니다. 내부 에너지뿐만 아니라 엔트로피의 물리적 의미는 분자 운동학적 관점에서 고립된 시스템에서 일어나는 과정을 고려할 때 명확하게 드러납니다. 7. 볼츠만 공식 격리된 시스템은 정의에 따라 물질이나 에너지를 환경과 교환하지 않습니다. 물론 그러한 시스템은 실제로 존재하지 않습니다. 그러나 시스템을 코르크로 밀봉된 보온병에 넣으면 매우 우수한 단열 효과를 얻을 수 있습니다. 자발적인 과정은 엔트로피의 증가가 특징인 경우에만 고립된 시스템에서 발생할 수 있습니다. 평형 상태에서 시스템의 엔트로피는 일정합니다. ∆S ≥ 0. 실험적 관찰에 기초한 이 진술은 열역학 제XNUMX법칙의 가능한 공식 중 하나입니다. 열역학 제XNUMX법칙에 따라 자발적에 반대되는 과정은 엔트로피 감소를 특징으로 하기 때문에 고립된 시스템에서 진행될 수 없습니다. 다양한 고립된 시스템에 대한 조사는 자발적인 과정이 항상 시스템의 미시 상태 w의 수 증가와 관련되어 있음을 보여줍니다. 동일한 과정에서 시스템의 엔트로피 S는 증가합니다. 즉, 엔트로피는 미시 상태의 수가 증가함에 따라 증가합니다. 1872년에 다음과 같은 관계를 제안한 오스트리아 물리학자 L. Boltzmann은 처음으로 그러한 의존성의 존재를 알아차렸습니다. КБ =R/NA = 1,38 - 1023 J/K, 여기서 KБ - 볼츠만 상수, 기체 상수 R 대 아보가드로 상수 N의 비율과 동일A . 이 관계를 볼츠만 공식이라고 합니다. 볼츠만 공식을 사용하면 가능한 미시 상태의 수로부터 시스템의 엔트로피를 이론적으로 계산할 수 있습니다. 이러한 계산은 실험적으로 결정된 값과 잘 일치합니다. 특히, 0°K에서 결정질 물질의 미세상태의 수는 w에 가까운 것으로 알려져 있다.0 "1. 따라서 상대적인 값만 결정할 수 있는 내부 에너지 E 및 엔탈피 H와 대조적으로 결정화 물질의 엔트로피 절대값을 결정할 수 있습니다. 많은 경우 시스템의 미시 상태 수의 증가는 시스템 에너지의 더 가능성 있는 분포로의 전환과 함께 이 시스템의 무질서의 증가와 관련될 수 있습니다. 볼츠만 관계에 기초하여 엔트로피의 분자 운동학적 정의를 줄 수 있습니다. 엔트로피는 시스템이 주어진 상태에 있을 확률의 척도 또는 시스템의 무질서의 척도입니다. 엔트로피 개념의 중요성은 이 값을 기반으로 자발적인 과정의 방향을 예측할 수 있다는 사실 때문입니다. 그러나 엔트로피 측정을 공정 방향의 기준으로 적용하는 것은 열역학 제XNUMX법칙의 공식화에 따른 고립계에 한정된다. 8. 깁스 에너지 개방형 및 폐쇄형 시스템에서 프로세스의 자발성에 대한 기준으로 새로운 상태 기능인 Gibbs 에너지가 도입되었습니다. 이 함수는 이 함수를 유도하고 열역학 작업에 사용한 위대한 미국 물리학자 DW Gibbs(1839-1903)의 이름을 따서 명명되었습니다. 깁스 에너지는 다음 관계를 사용하여 엔탈피 H와 엔트로피 S로 결정됩니다. G = H - S, ∆G = ∆H - ∆S. 깁스 에너지에 기초하여 열역학 제XNUMX법칙은 다음과 같이 공식화될 수 있습니다. 등압 등온 조건(p, T = const)에서 이러한 프로세스만 시스템에서 자발적으로 발생할 수 있으며 그 결과 시스템의 깁스 에너지가 감소합니다(ΔG < 0). 평형 상태에서 의 깁스 에너지는 시스템은 변경되지 않습니다(G = const, AG = 0). ΔG < 0, p, T = 상수. 깁스 에너지가 생물 에너지 과정의 연구에서 중요한 역할을 한다는 것은 앞서 말한 것에서 비롯됩니다. 이 상태 기능을 사용하면 생물학적 시스템에서 자발적인 과정의 방향을 예측하고 달성 가능한 최대 효율을 계산할 수 있습니다. 엔탈피 H와 같은 깁스 에너지 G는 시스템 상태의 함수입니다. 따라서 깁스 에너지 ΔG의 변화는 엔탈피 ΔH의 변화와 유사한 방식으로 화학적 변형을 특성화하는 데 사용할 수 있습니다. 이러한 반응에 해당하는 Gibbs 에너지 변화를 나타내는 반응식을 열화학이라고도 합니다. 시스템의 깁스 에너지가 감소하고(ΔG < 0) 작업이 수행되는 화학 반응을 엑서고닉이라고 합니다. Gibbs 에너지가 증가하고(ΔG > 0) 시스템에서 작업이 수행되는 반응을 엔더고닉이라고 합니다. 열역학 제XNUMX법칙에서 파생된 깁스 에너지는 상태의 함수입니다. 따라서 엔탈피와 마찬가지로 깁스 에너지에 대한 헤스 법칙은 다음과 같은 형식으로 공식화될 수 있습니다. 일정한 압력과 온도에서 주어진 시약으로부터 주어진 생성물이 형성되는 동안 깁스 에너지의 변화는 이러한 생성물의 형성을 초래하는 반응의 수와 유형에 의존하지 않습니다. Hes의 법칙 적용의 중요한 예는 포도당 산화와 이산소 반응의 Gibbs 에너지 계산입니다. p = 101kPa 및 T = 298°K에서 이 반응에서 깁스 에너지의 변화는 신체 외부에서 측정되며 ΔG° = 2880kJ/mol입니다. 해당 열화학 방정식은 다음과 같이 작성됩니다. С6Н12О6 + 6O2 = 6CO2 + 6시간2오, ΔG피아° = 2880kJ/mol. 신체의 세포에서 이 반응은 생화학자들에 의해 연구된 여러 연속적인 단계를 통해 수행됩니다. 모든 중간 반응에서 깁스 에너지 변화의 합은 ΔG임을 헤스의 법칙에서 예측할 수 있습니다.피아: △G1 +ΔG2 +ΔG3 + … + ∆Gn = ∆G피아 🇧🇷. 반응의 깁스 에너지는 화학량론적 양의 생성물 형성에 대한 깁스 에너지의 대수적 합에서 화학량론적 양의 반응물 형성에 대한 깁스 에너지의 대수적 합을 뺀 것과 같습니다. △G피아 = (nc△Gc + 엔D△GD)(NA△GA + 엔B△GB). 9. 솔루션. 솔루션 분류 응집 상태에 따라 용액은 기체, 액체 및 고체일 수 있습니다. 모든 솔루션은 용질과 용매로 구성되지만 이러한 개념은 다소 임의적입니다. 예를 들어, 알코올과 물의 양의 비율에 따라 이 시스템은 물에 알코올을 용해하거나 알코올에 물을 용해할 수 있습니다. 일반적으로 용매는 용해 전과 동일한 응집 상태로 용액에 존재하는 성분으로 간주됩니다. 혈액, 림프, 소변, 타액, 땀과 같은 가장 중요한 생물학적 체액은 염분, 단백질, 탄수화물, 물의 지질 용액이기 때문에 용액 교리는 의사에게 특히 중요합니다. 생물학적 체액은 영양소(지방, 아미노산, 산소), 약물을 장기 및 조직으로 운반하고 신체에서 대사물(요소, 빌리루빈, 이산화탄소 등)을 배출하는 데 관여합니다. 혈장은 림프구, 적혈구, 혈소판과 같은 세포의 매개체입니다. 신체의 액체 매체에서 산도의 불변성, 염분 및 유기 물질의 농도가 유지됩니다. 이 불변성을 농도 항상성이라고 합니다. 솔루션 분류 몰 질량이 5000g/mol 미만인 물질의 용액을 저분자량 화합물(NMS) 용액이라고 하고, 몰 질량이 5000g/mol 이상인 물질의 용액을 고분자량 화합물 용액( 현대자동차). 전해 해리의 유무에 따라 NMS 용액은 전해질 용액과 비전해질 용액의 두 가지 등급으로 나뉩니다. 전해질 용액 - 이온으로 해리되는 염, 산, 염기, 양쪽성 전해질 용액. 예를 들어, KNO 솔루션3, HCl, KOH, Al(OH)3 , 글리신. 전해질 용액의 전기 전도도는 용매의 전기 전도도보다 높습니다. 비전해질 용액 - 물에서 실질적으로 해리되지 않는 물질 용액. 예를 들어, 자당, 포도당, 요소 용액. 비전해질 용액의 전기 전도도는 용매의 전도도와 거의 다릅니다. NMS 용액(전해질 및 비전해질)은 콜로이드 용액과 달리 참이라고 합니다. 진정한 용액은 균질한 조성과 용질과 용매 사이에 계면이 없다는 특징이 있습니다. 용해된 입자(이온 및 분자)의 크기가 10 미만9엠 대부분의 IUD는 분자(고분자)가 화학 결합으로 연결된 다수의 반복 그룹 또는 단량체 단위로 구성된 중합체입니다. IUD 용액을 고분자 전해질 용액이라고 합니다. 고분자전해질에는 다중산(헤파린, 폴리아데닐산, 폴리아스파르트산 등), 다중염기(폴리리신), 다중양성전해질(단백질, 핵산)이 포함됩니다. HMS 솔루션의 속성은 NMS 솔루션의 속성과 크게 다릅니다. 따라서 별도의 섹션에서 논의될 것입니다. 이 장에서는 저분자량 전해질, 양쪽성 전해질 및 비전해질의 용액에 대해 설명합니다. 10. 용매로서의 물 우리 행성에서 가장 흔한 용매는 물입니다. 평균 체중 70kg인 사람의 몸에는 약 40kg의 물이 들어 있습니다. 동시에 약 25kg의 물이 세포 내부의 액체에 떨어지고 15kg은 혈장, 세포 간 액, 뇌척수액, 안내 액 및 위장관의 액체 내용물을 포함하는 세포 외액입니다. 동물 및 식물 유기체에서 수분은 일반적으로 50% 이상이며 경우에 따라 수분 함량이 90-95%에 이릅니다. 변칙적 특성으로 인해 물은 생명체에 완벽하게 적응한 독특한 용매입니다. 우선, 물은 이온성 및 많은 극성 화합물을 잘 용해시킵니다. 물의 이러한 특성은 유전 상수(78,5)가 높기 때문입니다. 물에 잘 녹는 또 다른 종류의 물질에는 설탕, 알데히드, 케톤 및 알코올과 같은 극성 유기 화합물이 포함됩니다. 물에 대한 용해도는 물 분자가 이러한 물질의 극성 작용기와 극성 결합을 형성하는 경향으로 설명됩니다(예: 알코올 및 설탕의 수산기 또는 알데히드 및 케톤의 카르보닐기의 산소 원자). 다음은 생물학적 시스템에서 물질의 용해도에 중요한 수소 결합의 예입니다. 극성이 높기 때문에 물은 물질의 가수분해를 일으킵니다. 물은 신체 내부 환경의 주요 부분이기 때문에 신체의 흡수, 영양소 및 대사 산물의 이동 과정을 제공합니다. 물은 물질, 특히 포도당의 생물학적 산화의 최종 생성물이라는 점에 유의해야 합니다. 이러한 과정의 결과로 물이 형성되면 약 29 kJ / mol의 많은 양의 에너지가 방출됩니다. 물의 다른 변칙적 특성도 중요합니다. 높은 표면 장력, 낮은 점도, 높은 융점 및 끓는점, 고체 상태보다 액체 상태의 밀도가 더 높습니다. 물은 수소 결합으로 연결된 분자 그룹인 동료의 존재가 특징입니다. 물에 대한 친화력에 따라 용해된 입자의 작용기는 친수성(물을 끌어당김), 물에 쉽게 용해되는, 소수성(반수성) 및 양친매성으로 나뉩니다. 친수성 그룹에는 극성 작용기가 포함됩니다: 하이드록실 -OH, 아미노 -NH2 , 티올 -SH, 카르복실 -COOH. 소수성 - 비극성 그룹, 예를 들어 탄화수소 라디칼: CHXNUMX-(CH2)п -, 에서6Н5 -. 아미노산은 분자에 친수성 그룹(-OH, -NH)을 모두 포함하는 물질(아미노산, 단백질)을 포함합니다.2 , -SH, -COOH) 및 소수성 기: (CH3 - (CH2)п ,-에서6Н5-). 양친매성 물질이 용해되면 소수성 그룹과의 상호 작용 결과 물의 구조가 변경됩니다. 소수성 그룹에 가까운 물 분자의 배열 정도가 증가하고 물 분자와 소수성 그룹의 접촉이 최소화됩니다. 결합하는 소수성 그룹은 물 분자를 해당 위치에서 밀어냅니다. 11. 용액의 농도와 표현방법 솔루션 평형 상태에서 두 개 이상의 물질로 구성된 가변 조성의 균질 시스템을 호출합니다. 용액을 구성하는 물질을 용액 성분이라고 합니다. 용액의 중요한 특성은 농도입니다. 이 값은 솔루션의 많은 속성을 결정합니다. 물질 농도 (용액 성분)은 용액이나 용매의 일정한 질량이나 부피에 포함된 용질의 양으로 측정한 양입니다. 농도를 표현하는 가장 일반적으로 사용되는 방법은 질량 분율, 몰 농도, 몰 당량 농도, 몰 분율, 부피 분율, 역가입니다. 질량 분율 W(X) 단위, 퍼센트(%), ppm(퍼센트의 1분의 XNUMX) 및 백만분율(ppm)의 분수로 표시됩니다. 질량 분율은 다음 공식으로 계산됩니다. W(X) =m(X)/중(pp), W(X) =m(X)/중(pp) × 100%, 어디야?(X) - 주어진 성분 X(용질)의 질량, kg(g); m (pp)은 용액의 질량, kg(g)입니다. 몰 농도는 mol/m로 표시됩니다.3 , 몰/디엠3 , 몰/cm3 , mol/l, mol/ml. 의학에서는 mol/l 단위를 사용하는 것이 바람직합니다. 몰 농도는 다음 공식으로 계산됩니다. C(X) =n(엑스)/V(pp) =m(X)/M(X) ×V(르), 여기서 n(엑스) - 시스템의 용해된 물질의 양, mol; M(X) 는 용질의 몰 질량, kg/mol 또는 g/mol입니다. m(X) 용해된 물질의 질량은 각각 kg 또는 g입니다. V(르) - 용액의 부피, l. 몰 농도 b(X) mol/kg 단위로 표시됩니다. 기록 형식, 예: b(HCl) \u0,1d XNUMX mol/kg. 공식으로 몰 농도를 계산합니다. b(X) =n(엑스)/m(ㄹ) =m(X)/M(X) ×m(ㄹ) 어디야?(ㄹ) - 용매의 질량, kg. 화학에서는 등가 및 등가 계수의 개념이 널리 사용됩니다. 동등한 주어진 산-염기 반응에서 하나의 수소 이온 또는 주어진 산화 환원 반응에서-XNUMX 개의 전자 또는 주어진 염 사이의 교환 반응에서-단위에 해당하는 물질 X의 실제 또는 조건부 입자가 호출됩니다. 요금. 부피 분율 f(엑스) 단위의 분수 또는 백분율로 표시되며 다음 공식으로 계산됩니다. Ф(엑스) = V(X)/V(르) 어디서 v(X) - 용액의 성분 X의 부피; V(르) 는 용매의 총 부피입니다. 용액의 역가는 T로 표시됩니다.(엑스), 측정 단위 - kg/cm3 , g/cm3 , g/ml. 용액의 역가는 다음 공식을 사용하여 계산할 수 있습니다. Т(엑스) =m(X)/V(르) 어디야?(X) 물질의 질량, 일반적으로 g; V(르) 용액의 부피, ml. 12. 용해 과정 용해 과정의 특성은 복잡합니다. 당연히 일부 물질은 일부 용매에는 쉽게 용해되고 다른 물질에는 거의 용해되지 않거나 거의 용해되지 않는 이유에 대한 의문이 생깁니다. 솔루션의 형성은 항상 특정 물리적 프로세스와 관련이 있습니다. 그러한 과정 중 하나는 용질과 용매의 확산입니다. 확산으로 인해 입자(분자, 이온)가 용해된 물질의 표면에서 제거되고 용매 전체에 고르게 분포됩니다. 이것이 교반이 없을 때 용해 속도가 확산 속도에 의존하는 이유입니다. 그러나 다양한 용매에 대한 물질의 불균등한 용해도는 물리적인 과정만으로는 설명할 수 없습니다. 위대한 러시아 화학자 D. I. Mendeleev(1834-1907)는 화학 과정이 용해에 중요한 역할을 한다고 믿었습니다. 그는 황산 수화물의 존재를 증명했습니다. H2그래서4H2오, H2그래서42H2오, H2그래서44H2O 및 일부 기타 물질, 예를 들어 C2Н5OH3H2A. 이러한 경우 용해는 용질 입자와 용매 사이의 화학 결합 형성을 동반합니다. 이 과정을 용매화(solvation)라고 하며, 용매가 물인 특별한 경우에는 수화(hydration)라고 합니다. 확립된 바와 같이, 용질의 성질에 따라 물리적 상호작용의 결과로 용매화물(수화물)이 형성될 수 있습니다: 이온-쌍극자 상호작용(예: 이온 구조(NaCl 등)을 가진 물질을 용해할 때), 쌍극자-쌍극자 상호 작용 - 분자 구조를 가진 물질을 용해할 때(유기 물질 )). 화학 상호 작용은 기증자 - 수용체 결합으로 인해 수행됩니다. 여기서 용질 이온은 전자 수용체이고 용매(Н2오, NH3) - 전자 공여체(예: 아쿠아 콤플렉스 형성) 및 수소 결합 형성(예: 물에 알코올 용해)의 결과. 용질과 용매의 화학적 상호 작용에 대한 증거는 용해에 수반되는 열 효과 및 색상 변화에 의해 제공됩니다. 예를 들어, 수산화칼륨이 물에 용해되면 열이 방출됩니다. KOH + xN2O \uXNUMXd KOH (N2오; ΔH°해결책 = 55kJ/mol. 염화나트륨이 용해되면 열이 흡수됩니다. NaCl + xH2O = 염화나트륨(H2오; ΔH°해결책 = +3,8kJ/mol. 물질 1몰이 용해될 때 방출되거나 흡수되는 열을 용액 Q의 열해결책 열역학 제XNUMX법칙에 따르면 Q해결책 = ΔH해결책, 여기서 ΔH해결책 주어진 양의 물질이 용해될 때 엔탈피의 변화입니다. 물에 무수 백색 황산동을 용해하면 강렬한 청색이 나타납니다. 용매화물의 형성, 색 변화, 열 효과 및 기타 여러 요인은 용액이 형성되는 동안 용액 성분의 화학적 성질의 변화를 나타냅니다. 따라서 현대 개념에 따르면 용해는 물리적 및 화학적 유형의 상호 작용이 모두 역할을하는 물리 화학적 과정입니다. 13. 용해 과정의 열역학 열역학 제XNUMX법칙에 따르면 p, T = const에서 이 과정의 결과로 시스템의 깁스 에너지가 감소하면 물질은 임의의 용매에 자발적으로 용해될 수 있습니다. ΔG = (ΔН - TΔS) < 0. ΔН의 값을 엔탈피 인자라고 하고, TΔS의 값을 용해 엔트로피 인자라고 합니다. 액체와 고체 물질이 용해될 때, 용해된 물질은 더 질서 있는 상태에서 덜 질서 있는 상태로 이동하기 때문에 시스템의 엔트로피는 일반적으로 증가합니다(ΔS > 0). 용해도 증가에 기여하는 엔트로피 인자의 기여는 승온에서 특히 두드러지는데, 이 경우 인자 T가 크고 제품 TΔS의 절대값도 각각 크기 때문에 깁스의 감소 에너지가 증가합니다. 액체에 기체를 녹일 때 덜 질서 있는 상태(대량)의 용질이 더 질서 있는 상태(작은 부피)로 이동하기 때문에 시스템의 엔트로피는 일반적으로 감소합니다(ΔS < 0). 온도의 감소는 기체의 용해에 유리합니다. 이 경우 인자 T가 작고 곱 TΔS의 절대값이 더 작아지고 깁스 에너지의 감소가 클수록 T 값이 더 낮기 때문입니다. 용액이 형성되는 동안 시스템의 엔탈피도 증가(NaCl) 및 감소(KOH)할 수 있습니다. 용해 과정의 엔탈피 변화는 Hess 법칙에 따라 용해 과정을 수반하는 모든 과정의 엔도 및 발열 기여도의 대수적 합으로 간주되어야 합니다. 이들은 물질의 결정 격자 파괴, 분자 결합 파괴, 용매의 초기 구조 파괴 및 용매화물을 포함한 다양한 상호 작용 생성물 형성의 발열 효과의 흡열 효과입니다. 표현의 단순화를 위해, 용해 엔탈피 ΔН의 증분해결책 에너지 차이 E로 나타낼 수 있습니다.cr, 용해된 물질의 결정 격자 파괴에 소비되고 에너지 E소금, 용매 분자에 의해 용질 입자가 용매화되는 동안 방출됩니다. 즉, 엔탈피 변화는 엔탈피 변화 ΔH의 대수적 합입니다.cr 결정 격자의 파괴와 엔탈피 ΔН의 변화의 결과소금 용매 입자에 의한 용매화로 인해: ΔH해결책 = ΔHcr + ΔH소금, 여기서 ΔH해결책 - 용해 중 엔탈피 변화. 그러나 유기 용매에 희가스를 용해할 때 열 흡수가 동반되는 경우가 많습니다(예: 아세톤, 벤젠, 에탄올 및 시클로헥산의 헬륨 및 네온). 분자 결정 구조를 가진 고체와 액체를 녹일 때 분자 결합은 그다지 강하지 않으므로 일반적으로 ΔH소금 > ΔNcr 이것은 예를 들어 알코올과 당의 용해가 발열 과정이라는 사실로 이어집니다(ΔН해결책 <0). 이온 격자가 있는 고체를 용해할 때 에너지 비율 Ecr 그리고 전자소금 다를 수 있습니다. 그러나 대부분의 경우 이온의 용매화 동안 방출된 에너지는 결정 격자의 파괴에 소비된 에너지를 보상하지 않으므로 용해 과정은 흡열입니다. 따라서 열역학 데이터는 열역학 제XNUMX법칙과 제XNUMX법칙을 기반으로 다양한 물질의 자발적 용해를 예측할 수 있습니다. 14. 용해도 용질이 용매와 접촉하면 많은 경우 용액 형성 과정이 특정 제한 농도에 도달할 때까지(포화 발생) 자발적으로 진행됩니다. 이것은 평형에 도달하고 엔탈피와 엔트로피 인자가 같을 때 발생합니다. 즉, ΔН = TΔS입니다. 예를 들어, 결정이 액체에 도입되면 분자 또는 이온이 결정 표면에서 용액으로 전달됩니다. 확산으로 인해 입자는 용매 전체에 고르게 분포됩니다. 용해는 포화 상태로 진행됩니다. 주어진 온도에서 과량의 용질과 평형 상태에 있는 최대 양의 용질을 포함하는 용액을 포화 용액이라고 합니다. 과포화 용액은 포화 용액보다 농도가 높은 용액입니다. 포화 용액보다 농도가 낮은 용액을 불포화 용액이라고 합니다. 특정 용매에 용해되는 물질의 능력을 용해도라고 합니다. 수치적으로 물질의 용해도는 포화 용액의 농도와 같습니다. 용해도는 농도와 같은 단위로 표현될 수 있습니다. 예를 들어, 포화 용액 1리터에 포함된 용질의 양, mol/l로 표시하거나, 포화 용액 100g에 들어 있는 용질의 질량으로 표시할 수 있습니다. . 용해도의 단위는 용매 100g당 그램입니다. 해당 값을 용해도 계수라고 합니다. 용해도는 용질과 용매의 성질, 온도, 압력, 용액 내 다른 물질의 존재 여부에 따라 달라집니다. 성분의 성질의 용해도에 대한 영향 용해되는 물질의 능력은 용액 X의 구성 요소 분자 사이의 상호 작용력의 특성에 의해 결정됩니다.1 그들을2 : 용제 - 용제(X1 - 엑스1 ), 용질 - 용질(X2 - 엑스2 ), 용매 - 용질(X1 - 엑스2 ) (점은 분자 결합을 나타냄). 물질의 용해도는 매우 다양합니다. 예는 동일한 용매(물)에서 다른 염의 용해도와 동일한 물질(AgNO)의 용해도를 보여줍니다.3 ) 다양한 용매에서. 이온 결합을 가진 물질과 극성 분자로 구성된 물질은 물, 알코올과 같은 극성 용매에 더 잘 용해됩니다. 이러한 용매는 높은 유전 상수를 특징으로 합니다. 물질의 높은 용해도는 종종 분자간, 특히 수소 결합의 형성으로 인해 발생합니다. 따라서 물과 알코올의 무한한 상호 용해도는 물과 알코올 분자 사이의 수소 결합 형성으로 설명되며, 암모니아 수용액에서 AgcI 결정의 용해는 화학적 도너-억셉터 결합의 형성으로 설명됩니다. 암모니아 분자가 있는 은 이온(AgCl은 물에 거의 녹지 않음). 같은 이유로 유전율이 낮은 용매인 피리딘은 매우 높은 용해도를 나타낸다. 용해도는 진정한 평형을 특징짓기 때문에 이 상태(압력, 온도)에 대한 외부 조건의 영향은 르 샤틀리에 원리를 사용하여 정성적으로 추정할 수 있습니다. 이러한 평가는 딥 다이빙 연습, 핫 샵 등에서 작업할 때 필요합니다. 15. 액체에서 기체의 용해도. Henry-Dalton과 Sechenov의 법칙 액체에서 가스의 용해는 거의 항상 열 방출을 동반합니다. 따라서 기체의 용해도는 르 샤틀리에의 원리에 따라 온도가 증가함에 따라 감소합니다. 이 패턴은 끓임으로써 물에서 용해된 가스(예: CO02)를 제거하는 데 자주 사용됩니다. 때때로 가스 용해는 열 흡수를 동반합니다(예: 일부 유기 용매에서 희가스 용해). 이 경우 온도를 높이면 기체의 용해도가 증가합니다. 기체는 액체에 무한정 용해되지 않습니다. 특정 가스 농도 X에서 평형이 설정됩니다.  기체가 액체에 용해되면 시스템의 부피가 크게 감소합니다. 따라서 Le Chatelier의 원리에 따르면 압력이 증가하면 평형이 오른쪽으로 이동해야 합니다. 즉, 기체의 용해도가 증가합니다. 기체가 주어진 액체에 약간 용해되고 압력이 낮으면 기체의 용해도는 압력에 비례합니다. 이 종속성은 Henry의 법칙(1803)으로 표현됩니다. 평형 상태에서 주어진 부피의 액체에 주어진 온도에서 용해된 기체의 양은 기체의 압력에 정비례합니다. 헨리의 법칙은 다음과 같은 형식으로 쓸 수 있습니다. с (엑스) = 케이r(엑스) ×P(X) 여기서 포화 용액의 가스 농도는 mol/l입니다. P(X) - 용액에 대한 가스 압력 X, Pa; Kr(엑스) - 기체 X에 대한 헨리 상수, mol × l1 × Pa1 . 헨리 상수는 기체, 용매 및 온도의 성질에 따라 달라집니다. Henry의 법칙은 낮은 압력에서 용해된 기체 분자와 용매 사이의 화학적 상호 작용이 없는 비교적 희석된 용액에만 유효합니다. Henry의 법칙은 일반 Dalton의 법칙의 특별한 경우입니다. 하나의 기체 물질이 아니라 기체 혼합물의 용해에 대해 이야기하고 있다면 각 성분의 용해도는 Dalton의 법칙을 따릅니다. 일정한 온도에서 기체 혼합물의 각 성분의 용해도는 액체 위 성분의 부분압에 비례하며 혼합물의 총 압력 및 다른 성분의 개별성에 의존하지 않습니다. 즉, 액체에 기체 혼합물이 용해되는 경우 분압 p! 이 구성 요소. 구성 요소의 부분 압력은 기체 혼합물의 총 압력에서 구성 요소 압력의 비율로 이해됩니다. Рi/ R합계 구성 요소의 부분 압력은 다음 공식으로 계산됩니다. 전해질이 있는 상태에서 액체에서 기체의 용해도를 연구하면서 러시아 생리학자 I. M. Sechenov(1829-1905)는 다음과 같은 패턴(Sechenov의 법칙)을 확립했습니다. 전해질이 있는 상태에서 액체에서 기체의 용해도는 감소합니다. 가스가 방출됩니다. Рi = 피합계 ×(엑스i) 어디서 피i - 성분 X의 부분압i; Р합계 가스 혼합물의 총 압력; 더블 엑스i)는 i번째 성분의 몰분율입니다. 전해질이 있는 상태에서 액체에서 기체의 용해도를 연구하면서 러시아 생리학자 I. M. Sechenov(1829-1905)는 다음과 같은 패턴(Sechenov의 법칙)을 확립했습니다. 전해질이 있는 상태에서 액체에서 기체의 용해도는 감소합니다. 가스가 방출됩니다. 16. 생물학적 시스템에서 물질 전달 과정에서 확산의 역할 확산은 생물학적 시스템에서 중요한 역할을 합니다. 우선 조직액에서 영양소와 대사산물의 이동은 확산을 통해 일어난다. 또한, 많은 경우 생물체의 물리화학적 과정의 속도는 반응물의 확산 속도에 의해 결정되는데, 이는 일반적으로 반응물의 확산이 가장 느린 과정인 반면, 효소를 포함하는 생화학 반응은 매우 빠르게 진행되기 때문입니다. 빠르게. 모든 살아있는 세포는 세포 내 환경을 보호하고 조절하는 역할을 하는 막으로 둘러싸여 있습니다. 물질은 두 가지 주요 메커니즘, 즉 일반 확산(수동 수송)과 에너지 활성화 전달(능동 수송)에 의해 막을 통과합니다. 멤브레인의 내부 층은 탄화수소 사슬로 구성됩니다. 따라서 많은 작은 중성 분자와 비극성 HMS 분자가 이 층에 용해되며 농도 구배를 따라 수직 확산에 의해 막을 통과할 수 있습니다. 이러한 물질 수송을 수동적이라고 합니다. 확산은 폐에서 혈액의 산소화 과정에서 중요한 역할을 합니다. 큰 가지로 인해 폐의 폐포 표면이 커서(~80m2) 산소가 혈장에 활발히 용해되어 적혈구로 들어갑니다. 정맥혈은 산소가 고갈되어 정맥혈의 산소 농도는 XNUMX이 되는 경향이 있습니다. 따라서 대기와 폐로 들어가는 혈액 사이의 산소 농도 구배가 높아 활성 흡수가 발생합니다(Fick의 법칙에 따름). 구배에 대해 저농도 영역에서 고농도 영역으로 물질이 이동하는 것을 능동 수송이라고합니다. 이러한 프로세스는 자발적으로 진행될 수 없으며 에너지 비용이 필요합니다. 에너지원은 생체 무기 화합물인 아데노신 삼인산(ATP)의 엑소에르고닉 가수분해 반응입니다. 세포 내부와 외부의 K 이온 농도의 안정적인 고정 분포는 막을 통해 세포로 K 이온의 흐름이 수동 확산으로 인해 세포에서 K 이온의 흐름과 같아질 때 달성됩니다. 분포(이온 항상성)는 Na 이온에 대해 유사하게 달성되며, 이온의 능동 수송 및 보상 수동 확산만이 K 이온의 해당 플럭스와 반대 방향으로 향합니다. 확산 과정은 의학에서 널리 사용됩니다. 예를 들어, 농도 구배를 따라 반투막을 통한 저분자량 물질 확산의 선택성에 기초한 투석 방법은 "인공 신장" 장치를 생성하기 위해 임상 실습에서 사용됩니다. IUD 입자는 반투막을 통과하지 못하므로 유해한 저분자 물질인 "슬래그"(요소, 요산, 빌리루빈, 아민, 과잉 K 이온)로부터 투석을 통해 생물학적 유체(예: 혈장)를 정화할 수 있습니다. 다양한 질병에 축적됩니다. 정화하는 동안 환자의 정맥에서 채취한 혈액은 반투과성 막이 있는 특수 챔버로 들어가 NMS가 확산되어 혈장에서 제거될 수 있습니다. 많은 염증성 질환에서 단백질 파괴가 일어나며, 혈장에는 NMS와 함께 제거되어야 하는 단백질 단편(펩티드 및 폴리펩티드)이 있습니다. 17. 용액의 어는점을 낮추고 끓는점을 높입니다. 용액에 대한 증기압 감소의 직접적인 결과는 어는점 ΔT의 변화입니다.з 용액의 끓는점 ΔTк 순수한 용매에 대한 이러한 양의 값과 비교합니다. 이러한 양 사이의 관계는 열역학 제XNUMX법칙에서도 따릅니다. 액체의 끓는점은 증기압이 외부 압력과 같아지는 온도입니다(예: 101,3kPa에서 물의 끓는점은 100°C). 액체의 어는점(결정화)은 액체 위의 증기압이 고체상의 증기압과 같은 온도입니다. 용액 T3 및 Tk의 어는점과 끓는점을 지정하고 용매 T °에 대해 동일한 값을 지정하면3 및 T°к , 다음을 얻습니다. ΔTk = Tк - T°к > 0, ΔT3 = T°3 -티3 > 0. 용액의 끓는점을 높이고 어는점을 낮추는 효과는 Le Chatelier의 원리를 사용하여 정성적으로 설명할 수 있습니다. 실제로 평형 시스템에서 "액체 - 증기"(예: H2О(그리고) - 시간2О(G)) 용해성 비휘발성 물질을 도입하면 용액 위의 용매 증기압이 감소합니다. 증기압의 감소를 보상하고 이전 평형 상태를 달성하려면 프로세스가 흡열적이기 때문에 용액을 더 높은 온도(373°K 이상)로 가열해야 합니다. 평형 시스템 "고상 - 액체"가 있다고 가정합니다. 예를 들어 H2О(티) > 에이2О(그리고), 273°K에서. 일정량의 비휘발성 물질(고체상에서 불용성)이 액상에 용해되면 액상에서 물 분자의 농도가 감소합니다. Le Chatelier의 원리에 따라 액상에서 물의 양을 증가시키는 과정, 즉 얼음이 녹는 과정이 시작됩니다. 새로운 평형을 이루려면 용액을 냉각해야 합니다. 즉, 공정이 발열이기 때문에 온도를 낮춰야 합니다. 묽은 용액에 대한 Raoult의 법칙에 따르면 증기압의 감소는 용액의 농도에 비례합니다. 따라서 이러한 용액의 끓는점 증가와 어는점 감소는 농도가 증가함에 따라 증가해야합니다. 용액의 어는 것과 끓는 것을 연구하면서 Raul은 다음을 발견했습니다. 끓는점 ΔT의 증가к 빙점 ΔT를 낮추는 것3 비전해질의 희석 용액은 용액의 몰 농도에 정비례합니다. ΔTк =케이эb(엑스), ΔT3 = 케이з b(엑스), 어디서 b(X) - 몰 농도, mol/kg; Кз 그리고 Kэ - 비례 계수, kg × K × 몰1 , 각각 ebulliometric 및 cryometric 상수라고합니다. 상수 K의 물리적 의미э 그리고 Kз 우리가 b를 받아들이면 명확해진다(X) = 1. 그런 다음 Kэ = ΔTк , 및 Kз = ΔTз . 즉, ebulliometric 상수는 XNUMX 몰 용액의 끓는점 증가와 수치 적으로 같고 cryometric 상수는 XNUMX 몰 용액의 어는점 감소와 수치 적으로 같습니다. Ebuliometric 및 cryometric 상수는 용매의 특성에만 의존하며 용질(이상적인 용액)의 특성에는 의존하지 않습니다. 18. 삼투압 삼투는 용매에서 용액으로 또는 농도가 낮은 용액에서 농도가 더 높은 용액으로 반투막을 통해 용매 분자(확산)가 주로 일방적으로 침투하는 것입니다. 삼투의 발생에 필요한 조건은 반투막으로 분리 된 용매와 용액 또는 농도가 다른 두 가지 용액의 존재입니다. 열역학의 관점에서 볼 때 삼투압의 원동력은 시스템이 농도를 균등화하려는 경향입니다. 이 경우 시스템의 엔트로피가 증가하고 시스템이 덜 정렬된 상태로 들어가기 때문에 시스템의 깁스 에너지가 그에 따라 감소하고 화학 포텐셜이 균등화됩니다. 따라서 삼투는 자발적인 과정입니다. 간단한 실험은 삼투 메커니즘과 용액에 대한 증기압 변화 사이의 연결을 설명하는 예시 역할을 할 수 있습니다. 순수한 용매가 든 유리와 일부 비휘발성 물질의 용액이 든 유리(용기의 액체 수준은 동일함)가 닫힌 유리 용기에 있는 경우 잠시 후 내부의 액체 수준 첫 번째 유리는 감소하고 두 번째 유리의 용액 수준은 증가합니다. 이 경우 용매는 첫 번째 비커에서 두 번째 비커로 이동하는데, 이는 (Raoult의 법칙에 따라) 순수한 용매보다 용액 위의 용매 증기압이 더 낮기 때문입니다. 따라서 용매와 용액 사이의 공기 공간은 반투막으로 작용합니다. 반투성 벽이 있는 용기에 포도당 수용액을 채우고 이 용기의 액체 수준이 일치하도록 물이 담긴 다른 용기에 넣습니다. 삼투의 결과로 첫 번째 용기의 용액의 부피가 증가하고 이 용기의 액면이 점차 높아집니다. 이것은 삼투를 방지하는 추가적인 정수압을 생성합니다. 삼투 평형에서 액체 기둥의 정수압은 용액의 삼투압을 결정합니다. 삼투압 삼투를 멈추기 위해 용액에 가해야 하는 최소 수압으로 측정한 값이라고 합니다. 삼투압의 법칙. Van't Hoff는 전해질이 아닌 용액의 삼투압을 계산하기 위한 실험 방정식을 제안했습니다. 파이 = C(엑스)RT, 여기서 π - 삼투압, kPa; С(엑스) - 몰 농도, mol/l; R은 다음과 같은 보편적인 기체 상수입니다. 8,31 kPa - l / (몰 - K); T는 절대 온도, K입니다. Van't Hoff 법칙은 실험 데이터를 바탕으로 설정되었지만 ΔG = 0일 때 열역학적 평형 조건에서 도출할 수 있습니다. 따라서 이 법칙은 열역학 제XNUMX법칙의 결과로 간주되어야 합니다. 위 형식의 표현은 이상 기체에 대한 Clapeyron-Mendeleev 방정식과 유사하지만 이러한 방정식은 다른 프로세스를 설명합니다. 19. 생물학적 시스템에서 삼투압과 삼투압의 역할 삼투 현상은 많은 화학 및 생물학적 시스템에서 중요한 역할을 합니다. 삼투는 세포 및 세포 간 구조로의 물의 흐름을 조절합니다. 조직의 탄력성과 특정 형태의 장기를 보존하는 세포의 탄력성(turgor)은 삼투압에 의한 것입니다. 동물 및 식물 세포는 반투막의 특성을 갖는 껍데기 또는 원형질의 표면층을 가지고 있습니다. 이 세포를 농도가 다른 용액에 넣으면 삼투가 관찰됩니다. 삼투압이 같은 용액을 등장액이라고 합니다. 두 용액의 삼투압이 다른 경우 삼투압이 높은 용액은 두 번째 용액에 대해 고장성이고 두 번째 용액은 첫 번째 용액에 대해 저장성입니다. 세포를 등장액에 넣으면 크기와 기능이 정상적으로 유지됩니다. 세포를 저장성 용액에 넣으면 덜 농축된 외부 용액의 물이 세포로 들어가 팽창하여 세포막이 파열되고 세포 내용물이 유출됩니다. 이러한 세포의 파괴를 용해라고 하며, 적혈구의 경우 이 과정을 용혈이라고 합니다. 용혈 중에 세포 내용물이 나오는 혈액은 색 때문에 바니시 혈액이라고 합니다. 세포를 고장성 용액에 넣으면 더 농축된 용액에서 물이 세포를 떠나고 세포의 주름(건조)이 관찰됩니다. 이 현상을 plasmolysis라고 합니다. 인간의 체액(혈액, 림프액, 조직액)은 NaCl, KCl, CaCl, 고분자 화합물 - 단백질, 다당류, 핵산 및 형성 요소 - 적혈구, 백혈구, 혈소판과 같은 저분자량 화합물의 수용액입니다. 그들의 총 작용은 생물학적 체액의 삼투압을 결정합니다. 310°K(37°C)에서 인간 혈액의 삼투압은 780kPa(7,7atm)입니다. 동일한 압력은 0,9% NaCl 수용액(0,15mol/l)에 의해 생성되므로 혈액(식염수)과 등장성입니다. 그러나 혈액에는 Na 및 C1 이온 외에도 IUD 및 형성 요소뿐만 아니라 다른 이온도 있습니다. 따라서 의학적 목적으로 혈액을 구성하는 것과 동일한 성분 및 동일한 양의 용액을 사용하는 것이 더 정확합니다. 이 용액은 수술에서 혈액 대체제로 사용됩니다. 삼투압 외에도 인체는 불변성(항상성) 및 산도와 같은 혈액의 기타 물리화학적 지표가 특징입니다. 혈액의 삼투압의 허용 변동은 매우 작고 심각한 병리학에서도 수십 kPa를 초과하지 않습니다. 다양한 절차에서 등장성 용액 만 인간과 동물의 혈액에 대량으로 주입 할 수 있습니다. 큰 혈액 손실(예: 주요 수술, 부상 후)이 있는 경우 환자는 혈액으로 인한 체액 손실을 보상하기 위해 몇 리터의 등장액을 주사합니다. 삼투 현상은 의료 행위에서 널리 사용됩니다. 따라서 수술에서 화농성 상처에 주입되는 고장성 드레싱 (고장성 10 % NaCl 용액에 담근 거즈)이 사용됩니다. 삼투의 법칙에 따르면 거즈를 통한 상처액의 흐름은 바깥쪽으로 향하게되어 상처가 고름, 미생물 및 부패 생성물로 지속적으로 정화됩니다. 20. 해리도(이온화). 전해질의 강도 거의 완전히 이온화(이온화)되는 전해질을 강전해질, 완전히 이온화되지 않은 전해질을 약전해질이라고 합니다. 약한 전해질 용액에는 이온과 함께 이온화되지 않은 분자가 있습니다. S. Arrhenius가 약한 전해질 용액의 등장 계수가 정수와 같지 않은 이유를 설명한 것은 불완전한 이온화 때문이었습니다. 해리의 완전성을 정량적으로 특성화하기 위해 해리도(이온화)의 개념이 도입되었습니다. 전해질의 해리(이온화) 정도는 용액에 도입된 전체 분자 수에 대한 이온으로 분해된 분자 수의 비율입니다. 즉, 전해질 분자가 이온으로 분해되는 비율입니다. 해리 정도는 단위의 백분율 또는 분수로 표시됩니다. αн = Nн/ Np, 여기서 N은 이온으로 분해되는 전해질 분자의 수입니다. Np 용액에 도입된 전해질 분자의 수(용해). 그래서 C의 경우(CHXNUMXCOOH) = 0,1 mol/l, 해리도 αн = 0,013(또는 1,3%). 해리 정도에 따라 전해질은 일반적으로 강한 (αн > 30%) 및 약함(αн < 3%). 간격에서 전해질은 중간 강도로 간주됩니다. 거의 모든 염은 강한 전해질로 간주됩니다. 가장 중요한 산과 염기 중 H2SO4 , HCl, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . 약한 전해질에는 대부분의 유기산과 일부 무기 화합물이 포함됩니다.2에스, HCN, N2CO3 , 그래서3 , HClO, N2켜짐3VO3 , HG2CI2 , 철(SCN)3 . An은 이상적인 용액에 대한 이론적 의존성으로부터 전해질 용액의 조합 특성의 편차를 측정함으로써 실험적으로 결정됩니다. 예를 들어, 등장 계수 i는 cryoscopic 방법으로 결정된 다음 해리도가 계산됩니다.강한 전해질의 경우 거의 완전히 이온으로 해리되기 때문에 해리도가 분명합니다. 정수 지식에서 등장 계수 i의 편차는 솔루션에 관련되지 않은 분자의 존재가 아니라 다른 이유에 의해 설명됩니다. 해리는 열의 방출 또는 흡수를 동반합니다. 따라서 해리의 정도는 온도에 의존해야 합니다. 온도의 영향은 르 샤틀리에의 원리에 따라 추정할 수 있습니다. 열 흡수와 함께 전해 해리가 발생하면 온도가 증가함에 따라 증가하고 열이 방출되면 감소합니다. 전해 해리의 정도는 용액의 농도에 영향을 받습니다. 용액이 희석되면 해리도가 크게 증가합니다. 이와 관련하여 해리도 α에 따른 전해질 강도의 표시된 분류н 농도가 약 0,1 mol/l인 용액에만 유효합니다. 전해 해리를 평형 가역 과정으로 간주하면 Le Chatelier의 원리에 따라 물로 희석하면 증류된 분자의 수가 증가합니다. 즉, 해리도가 증가합니다. 약한 전해질의 해리 정도는 같은 이름의 이온을 추가해도 영향을 받습니다. 따라서 평형 시스템에 약한 전해질을 도입하면 이온 농도가 증가하여 Le Chatelier 원리에 따라 해리 평형이 왼쪽으로 크게 이동합니다. 즉, 해리 정도가 감소합니다. . 따라서 약한 전해질 용액에 같은 이름의 이온을 첨가하면 해리 정도가 감소합니다. 21. 해리 상수. 오스트발트의 번식법칙. 강한 전해질 용액 이론 정량적으로, 평형 가역 과정으로서의 전해 해리는 질량 작용 법칙에 의해 결정되는 해리(이온화) 상수로 특징지을 수 있습니다. 엄밀히 말하면 질량 작용의 법칙은 가역 반응, 즉 약한 전해질 용액에 적용됩니다. 예를 들어, KtnAnm 전해질의 해리는 평형 과정으로 나타낼 수 있습니다. Ktn Anm × nKtm+ +mAn . 질량 작용의 법칙에 따라 평형 상수는 다음과 같이 작성됩니다. КД = (Ktm+)n+(안n)m + (KtnAnm) 어디서 (Ktm+) 그리고n ) - 전해질 이온의 몰 평형 농도; (KtnAnm)는 해리되지 않은 전해질 분자의 몰 평형 농도이고; КД 해리 상수라고 하는 평형 상수입니다. 이 방정식은 약한 전해질의 희석 용액에만 유효합니다. 농축 용액 및 강한 전해질 용액에 적용할 때 방정식을 수정해야 합니다. 해리 상수 K가 클수록Д , 전해질이 더 많이 해리됩니다. 해리 정도 K와 대조적으로Д 용매, 전해질 및 온도의 특성에만 의존하며 용액의 농도에는 의존하지 않습니다. 따라서 상수와 전해 해리 정도는 모두 해리의 정량적 특성입니다. 당연히 그들 사이에는 연결이 있습니다. 다염기산 및 다산 염기는 단계적으로 해리됩니다. 예를 들어, 인산의 해리는 세 단계로 발생합니다.  유사하게 다산 염기(예: Ca(OH)2) - 해리는 두 단계로 일어난다. 단계적 해리는 각 후속 단계에서 전해질의 분해가 이전 단계보다 적은 정도로 발생한다는 사실이 특징입니다. 해리 상수의 변화의 이러한 특성은 쿨롱의 법칙에 기초한 정전기 인력으로 설명할 수 있습니다. 이온화 에너지는 이온이 중성 전해질 분자에서 분리될 때 최소입니다. 이온의 제거는 후속 단계에서 전하가 더 커지는 입자에서 발생하기 때문에 해리의 각 다음 단계에서 이온의 분리는 증가하는 에너지를 필요로 합니다. 용액의 농도에 관계없이 강한 전해질이 이온으로 거의 완전히 분리되는 것은 물리적 및 물리 화학적 연구 방법으로 확인됩니다. 따라서 희석 용액에서 강염기에 의한 모든 강산의 중화열 값은 거의 동일합니다. 산과 염기의 성질에 관계없이 동일한 값인 AH = 56,5 kJ/mol이 얻어진다. 이 사실은 산과 염기의 묽은 용액이 완전히 해리되었다는 분명한 증거입니다. 모든 경우에 중화 중에 발생하는 일반적인 과정은 mol의 이온 조합입니다. 22. 산과 염기 이론 많은 전해질, 특히 다양한 원소 E의 수산화물은 산 또는 염기의 특성을 나타냅니다. EON 수산화물의 해리는 두 가지 유형으로 진행될 수 있습니다. 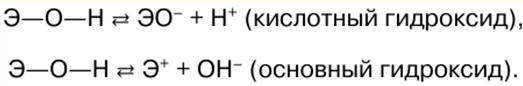 갭은 그룹의 두 결합을 따라 발생할 수 있습니다. 영겁. 알려진 바와 같이 결합의 극성과 강도는 원소의 전기 음성도, 원자의 크기 및 유효 전하의 차이에 따라 달라집니다. O-H 결합의 파괴 에너지가 E-O 결합의 파괴 에너지보다 훨씬 작으면 산 유형에 따라 수산화물의 해리가 진행됩니다. 반대로 OH 결합을 끊는 에너지가 E-O 결합을 끊는 에너지보다 훨씬 크면 주요 유형에 따라 해리가 진행됩니다. 알칼리 및 알칼리 토금속의 수산화물 및 낮은 산화 상태의 전이 금속에서 E-O 결합 강도는 상대적으로 낮고 산소는 수소에 더 강하게 결합되며 E-O-H 해리는 주로 염기성 유형에 따라 진행됩니다. 수산화물 디온 제거 . 이것은 그러한 원소의 이온이 다소 크고 유효 전하가 작기 때문입니다. 즉, 약한 분극 능력을 가지고 있기 때문입니다. 산화도가 증가함에 따라 E 원자의 분극 효과가 증가하고(비전하 증가), 산소는 원소 E에 더 단단히 결합되며, E-O-H의 해리는 주로 산 유형, 즉 , 수소 이온이 분리됩니다. 후자는 산소 원자에서 전자 밀도의 재분배와 관련이 있습니다. 결과적으로 E-O 결합은 더 강해지고 O-H 결합은 약해집니다. 현재, 산과 염기의 개념에 대한 명확한 정의는 없으며, 이는 모든 용매에서 산-염기 상호작용을 특성화하는 데 동등하게 사용될 수 있습니다. 수용액에서 많은 전해질을 특성화하기 위해 Arrhenius가 제공한 산과 염기의 개념을 여전히 사용할 수 있습니다. 1) 산은 용액에서 해리되어 수소 이온 H를 형성하는 전해질입니다. 2) 염기는 OH 수산화물 이온의 형성과 함께 용액에서 해리되는 전해질이다. 3) 양쪽성 전해질(양쪽성 수산화물)은 용액에서 해리되어 수소 이온과 수산화물 이온을 모두 형성하는 전해질입니다. 양쪽성 전해질에는 아연, 알루미늄, 크롬 및 기타 양쪽성 원소의 수산화물과 아미노산, 단백질, 핵산이 포함됩니다. Le Chatelier의 원리를 산-염기 평형 사슬에 적용하면 시스템에서 OH 수산화물 이온의 농도가 증가함에 따라 산 유형 해리 확률이 증가한다는 것을 알 수 있습니다. 시스템에서 수소 이온 H+의 농도가 증가하면 주요 유형에 따라 우세한 해리가 발생합니다. 이것은 산성 환경에서 ampholite가 기본 특성을 나타내고 알칼리성 환경에서 산성 특성을 나타낸다는 것을 의미합니다. 예를 들어, 수산화 아연은 산과 상호 작용할 때 염기처럼 행동합니다. Zn (OH)2 + 2HCl - ZnCl2 + 2시간2아 알칼리와 상호 작용할 때 - 산으로 : 아연(OH)2+ 2NaOH → 나2[아연(OH)4]. 23. 혈액 완충 시스템.혈장 완충 시스템은 유기체의 산-염기 균형을 유지하는 데 매우 중요합니다. 모든 살아있는 유기체의 세포 내 및 세포 외액은 완충 시스템의 도움으로 유지되는 일정한 pH 값이 특징입니다. 대부분의 세포내액의 pH 값은 6,8에서 7,8 사이입니다. 인간 혈액에서 KO 균형의 산-염기 균형은 탄산수소, 인산염 및 단백질 완충 시스템에 의해 제공됩니다. 혈장의 정상적인 pH 값은 7,40 ± 0 05입니다. 이것은 3,7에서 4,0x108 mol/l의 활성 산도 값 범위에 해당합니다. 혈액에는 다양한 전해질(HC03 , H2CO3 , H2RO4 , NRO42 ), 단백질, 아미노산, 이는 (H +)의 활성이 표시된 범위에 있을 정도로 해리됨을 의미합니다. 혈장과 혈액 세포의 무기물과 유기물 함량이 같지 않기 때문에 이러한 혈액 성분을 별도로 고려하는 것이 좋습니다. 혈장 HCO 버퍼 시스템3 / N2CO3 탄산으로 이루어져 있다2CO3 및 짝염기 HCO3 . 그것은 혈액에서 가장 중요한 완충 시스템입니다. 구성 요소 중 하나는 탄산 H입니다.2CO3 - 플라즈마에 용해된 CO의 상호작용에 의해 형성2 물과 함께: CO2(r) + 엔2그는 N2CO3. 어디 CO2(r) - 용존 CO 농도2 . 이 반응의 평형 상수는 다음과 같습니다. K = [N2CO3] / [CO2] CO 사이2 폐의 모세 혈관을 통해 흐르는 혈장의 폐포 및 탄산수소 완충액에서 평형 사슬이 설정됩니다. 탄산수소 완충 시스템은 pH 7,4 근처에서 효과적인 생리학적 완충제로 작용합니다. 산의 혈액에 들어갈 때 - H 기증자+ Le Chatelier 원리에 따른 사슬의 평형은 HCO 이온이3 H 이온을 H 분자에 결합2CO3 . 동시에 H의 농도는2CO3 증가하고 HCO 이온의 농도3 내려간다. H 농도 증가2CO3 균형이 왼쪽으로 이동합니다(르 샤틀리에의 원리). 부식을 유발합니다2CO3 그리고 CO 농도의 증가2 플라즈마에 용해. 결과적으로 평형이 왼쪽으로 이동하고 CO의 압력이 증가합니다.2 폐에. 초과 CO2 몸에서 배설됩니다. 결과적으로 혈액의 탄산수소 시스템은 빠르게 CO와 평형을 이룹니다.2 폐포에서 효과적으로 혈장의 pH를 일정하게 유지합니다. 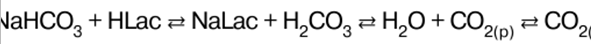 따라서 정상적인 혈액 pH 값은 산증으로 인한 약간 뚜렷한 pH 변화와 함께 유지됩니다. 밀폐된 공간에서 종종 질식(산소 부족), 호흡 증가를 경험합니다. 그러나 질식은 산소 부족이 아니라 과도한 CO2와 관련이 있습니다. 초과 CO2 Henry의 법칙에 따라 대기에서 CO가 추가로 용해됩니다.2 혈액에서. 그리고 이것은 혈액 pH의 감소, 즉 산증으로 이어집니다. 탄산수소 완충 시스템은 혈액 pH의 변화에 가장 빠르게 반응합니다. 그것의 산 완충 능력은 V입니다к \u40d XNUMXmmol / l의 혈장 및 알칼리에 대한 완충 용량은 훨씬 적으며 V와 거의 같습니다.щ = 혈장 1-2mmol/l. 24. 중화 반응 중화 반응은 산과 염기의 상호 작용의 교환 반응이라고하며 그 결과 염과 물이 형성됩니다. 다양한 유형의 중화 반응을 고려하십시오. 1. 강산으로 강염기를 중화: KOH + HNO3 -KNO3 + 엔2O. 이러한 반응에 대한 분자 이온 방정식 H+ + 오 → 엔2O 깁스 에너지 ΔG°의 음수 값은 평형이 실질적으로 물의 형성 쪽으로 이동함을 보여줍니다. 중화 반응의 일반적인 경우는 강도(해리 정도)가 다른 산과 염기의 상호 작용입니다. 이러한 반응은 염 가수분해의 역반응으로 인해 완료되지 않습니다. 2. 약산을 강염기로 중화:  또는 분자 형태:  이 경우 중화 반응은 가역적입니다. 약염기와 강산의 중화 반응도 가역적입니다.  또는 분자 형태: 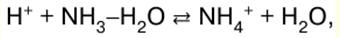 그리고 또한 - 약한 산을 가진 약한 염기: 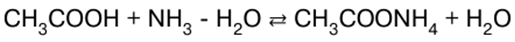 또는 분자 형태:  이러한 시스템에서 물은 시안화수소산, 암모니아 및 아세트산보다 전해질이 훨씬 약하기 때문에 평형이 오른쪽으로 강하게 이동합니다. 중화 반응은 중화 방법의 기초를 형성합니다. 이 방법은 위액의 산도, 혈장의 완충 용량을 결정하기 위해 임상 실험실에서 사용됩니다. 약리학에서는 무기산(염산, 황산, 붕산) 및 유기산(아세트산, 벤조산, 타르타르산, 구연산, 살리실산)의 정량 분석에 사용됩니다. 생물 약학 연구에서 산의 pKa와 염기의 pKa는 중화 방법에 의해 결정됩니다. 이러한 값의 값은 약물이 생물학적 막을 통과하는 능력을 예측할 수 있기 때문입니다. 산-염기 적정은 pK를 결정하는 데 사용됩니다.а 아미노산과 pKа 단백질의 해리 그룹. 두 가지 다른 온도에서 얻은 단백질 적정 곡선을 사용하여 카르복실, 이미다졸 및 기타 기의 수를 결정할 수 있습니다. 아미노산과 단백질의 적정을 통해 등전점을 결정할 수 있습니다. 가수분해는 물에 의한 물질의 분해입니다. 단백질, 지방, 탄수화물, 에스테르, 염 등 다양한 종류의 화합물이 가수분해될 수 있습니다. 무기 화학에서 염의 가수분해와 가장 자주 접하게 됩니다. 25. 염가수분해 염가수분해 - 이것은 염과 물 분자의 상호 작용으로 해리가 낮은 화합물이 형성됩니다. 가수분해 과정은 물 분자에서 주어진 이온(CO32 + HOH * HCO3+ 오 ) 또는 수화된 금속 양이온을 포함하여 주어진 이온에서 물 분자로. 염의 성질에 따라 물은 산 또는 염기로 작용하며, 염은 각각 짝염기 또는 짝산이다. 염의 종류에 따라 가수분해의 네 가지 변형이 가능합니다. 1. 강산과 약염기에 의해 형성된 염:  2. 강염기와 약산에 의해 형성된 염: CH3COONa + HOH → CH3COOH + NaOH. 3. 약산과 약염기에 의해 형성된 염. 시안화 암모늄은 다음 반응에 의해 가수 분해됩니다. 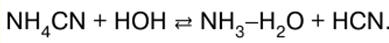 4. 강산과 강염기에 의해 형성된 염. NaCl, KNO3는 가수분해되지 않습니다. 염 가수분해의 메커니즘은 염 이온과 수화 껍질의 극성화 상호 작용으로 구성됩니다. 이 상호작용이 강할수록 가수분해가 더 강해집니다. 가수분해의 고려된 모든 경우는 XNUMX-산 염기 및 XNUMX-염기산에 의해 형성된 염에 관한 것입니다. 다염기산과 다산염기의 염은 단계적으로 가수분해되어 산성 및 염기성 염을 형성합니다. 정량적으로, CO 평형으로서의 가수분해는 가수분해 정도와 가수분해 상수를 특징으로 합니다. 가수분해도는 가수분해된 물질의 양과 용질의 총량의 비율로 측정합니다. 가수분해의 정도는 염의 성질, 농도 및 온도에 따라 다릅니다. 질량 작용의 법칙에 따르면 가수분해 정도는 용액의 희석에 따라 증가합니다. 그래서 농도에서 Na2CO3 0,001mol/l, 가수분해도는 34%이다. 일반적인 경우 다음 규칙이 참입니다. 1. 염가수분해는 온도가 증가하고 용액의 희석이 증가함에 따라 증가해야 합니다. 2. 가역적 가수분해에서 르 샤틀리에 원리에 따라 산성화(이 염이 강산과 약염기에 의해 형성되면 H 이온이 축적됨) 또는 알칼리화(염이 다음에 의해 형성되는 경우 약산과 강염기, OH 이온이 축적됨). 3. 난용성 또는 기체 생성물이 형성되어 반응 영역에서 제거되는 염의 가수분해(평형 이동의 원리)는 돌이킬 수 없습니다. 예를 들어, Pb(SO4)2 전적으로 PbO 침전물의 형성으로 인해 진행됩니다.2: 납(SO4)2 + 2시간2O→PbO2 + 2H2SO4. 가수분해는 많은 종류의 무기 및 유기 화합물의 특징입니다. 무기 화합물의 가수분해는 독성을 평가하는 데 중요합니다. 유기 화합물의 가수 분해는 목재, 지방, 에스테르 및 기타 물건에서 귀중한 제품을 얻는 데 사용되지만 가수 분해는 생물의 삶에서 특히 중요한 역할을합니다. 26. 침전 및 용해 반응 전해액에서 일어나는 교환반응에는 침전과 용해의 반응이 있다. 침전 반응은 침전을 동반합니다. 침전물이 용해되는 반응을 용해 반응이라고 합니다. 난용성 전해질의 침전물과 그 위에 포화 용액으로 구성된 시스템이 널리 사용됩니다. 이러한 시스템에서 포화 용액과 침전물 사이에 동적 평형이 설정됩니다. 용해도가 낮아 용액 내 난용성 전해질의 농도가 매우 낮아 용액 내에서 완전히 해리된 것으로 간주할 수 있습니다. 즉, 포화 용액에서 물질의 고체상과 용액으로 통과한 이온 사이에 동적 평형이 설정됩니다. 예를 들어, AgCl의 포화 용액에서 다음 평형이 발생합니다. AgCl(T) → 은+(피) + C 1(아르 자형). 상수값인 고체상 AgCl의 농도는 평형상수 식에서 제외된다. 결과적으로 평형상수는 용액 내 이온 농도의 곱에 의해서만 결정되며 상수 또는 용해도 곱이라고 합니다. 일반적으로 Ktn Anm 전해질의 경우 용해도 상수는 이온 농도의 화학량론적 곱에 의해 결정됩니다. Кпр= [Ktm+ ]n[안n]m 이 값은 이물질이 없는 일정한 온도에서 전해질의 용해도를 나타냅니다. K 불변성пр 용액에서 개별 이온 농도의 불변성을 의미하지는 않습니다. 따라서 예를 들어 AgNO를 첨가하여 AgCl의 포화 용액에서 Ag 이온의 농도를 증가시킬 수 있습니다.3 , Le Chatelier 원리에 따른 평형은 왼쪽으로 이동하여 이온 증착 속도가 증가합니다. 일정 시간이 지나면 AgCl의 용해 속도와 Ag 및 Cl 이온의 침전이 같아집니다. 새로 확립된 평형은 이전과 같이 K 값으로 특징지어집니다.пр(AgCl), 그러나 Ag와 Cl 이온의 평형 농도는 변할 것입니다. 따라서 K를 기반으로пр 두 가지 규칙에 따라 전해질 침전물의 형성과 용해를 예측할 수 있습니다. 1. 용액 내 이온 농도의 화학양론적 곱이 용해도 상수보다 클 때 전해질이 침전됩니다. 2. 용액 내 구성 이온 농도의 화학량론적 곱이 용해도 상수보다 작아지면 전해질 침전물이 용해됩니다. 침전 반응은 의약품의 정량 분석에 사용되는 침전 방법의 기초를 형성합니다. 침전 방법은 식수 분석에서 소변, 위액, 혈액의 염화물에 대한 임상 분석, 위생 및 위생 실습에 사용됩니다. 과학자들은 물에 있는 원소의 천연 화합물의 다양한 용해도가 살아있는 유기체의 함량에 큰 영향을 미쳤다고 믿습니다. 물에 대한 화합물의 용해도와 여러 원소 이온의 독성 효과 사이에는 밀접한 관계가 있습니다. 예를 들어, Al의 도입3 + 난용성 인산알루미늄 AlPO4의 형성으로 인해 체내로 27. 산화환원 반응 무기 화학의 기본 개념 중 하나는 산화 상태(CO)의 개념입니다. 화합물에 있는 원소의 산화 상태는 원자가 전자가 더 높은 상대 전기 음성도(REO)를 가진 원자로 전달되고 화합물 분자의 모든 결합이 이온성이라는 가정에서 계산된 원소 원자의 형식 전하입니다. 원소 E의 산화 상태는 숫자 앞에 "+" 또는 "-" 기호가 있는 원소 기호 위의 상단에 표시됩니다. 용액 또는 결정에 실제로 존재하는 이온의 산화 정도는 그들의 전하수와 일치하며 숫자 뒤에 기호 "+" 또는 "-"로 유사하게 표시됩니다(예: Cl).,카2+. 스톡 방법은 Mn(VII), Fe(III)와 같은 원소 기호 뒤에 로마 숫자로 산화 정도를 나타내는 데도 사용됩니다. 분자 내 원자의 산화 상태 기호에 대한 질문은 분자를 형성하는 상호 연결된 원자의 전기 음성도 비교를 기반으로 해결됩니다. 이 경우 전기 음성도가 낮은 원자는 양의 산화 상태를 가지며 전기 음성도가 높은 원자는 음의 산화 상태를 갖습니다. 산화 상태는 원소의 원자가로 확인할 수 없다는 점에 유의해야 합니다. 주어진 원자가 다른 원자와 연결된 화학 결합의 수로 정의되는 원자가는 XNUMX이 될 수 없으며 "+" 또는 "-" 기호가 없습니다. 산화 상태는 양수 값과 음수 값을 모두 가질 수 있으며 XNUMX과 분수 값도 가질 수 있습니다. 예를 들어, CO 분자에서2 C의 산화 상태는 +4이고 CH 분자에서4 C의 산화 상태는 4입니다. 두 화합물에서 탄소4a의 원자가는 IV입니다. 위의 단점에도 불구하고 산화도 개념의 사용은 화합물의 분류 및 산화환원 반응식의 공식화에 편리하다. 원소가 산화되면 산화 상태가 증가한다. 즉, 반응 중 환원제가 산화 상태를 증가시킨다. 반대로, 원소가 환원되면 산화 상태가 감소하는데, 즉 반응 중에 산화제가 산화 상태를 감소시킨다. 따라서 다음과 같은 산화 환원 반응 공식을 제공 할 수 있습니다. 산화 환원 반응은 반응 물질을 구성하는 원소 원자의 산화 상태 변화로 발생하는 반응입니다. 28. 산화제 및 환원제 생성물과 산화환원 반응의 방향을 예측하기 위해, 전형적인 산화제는 원자가 큰 EER> 3,0(VIA 및 VIIA 그룹의 요소)을 갖는 단순 물질임을 기억하는 것이 유용합니다. 이 중 가장 강력한 산화제는 불소(OEO = 4,0), 산소(OEO = 3,0), 염소(OEO = 3,5)입니다. 중요한 산화제에는 PbO가 포함됩니다.2 , KMnO4 , Ca(SO4)2 , 에게2크롬2O7 , HClO, HClO3, KSIO4, 나비오3, H2SO4(끝), H.N.O.3(끝) , 나2O2 , (NH4)2S2O8 , KSIO3 , H2O2 및 더 높거나 더 높은 CO 원자를 포함하는 기타 물질. 일반적인 환원제는 원자의 EER이 1,5 미만인 단순 물질(IA 및 IIA 그룹의 금속 및 일부 기타 금속)을 포함합니다. 중요한 환원제에는 H가 포함됩니다.2에스, NH3, 하이, 키, SnCl2 , FeXNUMXSO4 ,C,H2 , 콜로라도, H2SO3 , cr2(그래서4)3 , CuCl, Na2S2O3 및 낮은 CO 원자를 포함하는 기타 물질. 각각 최대 및 최소 산화 상태의 원자를 포함하는 물질은 산화제일 수 있습니다(예: K2SG2O7 , KMPO4 , PbO2 , 염산4 또는 NH와 같은 환원제만3 , H2에스, 하이. 중간 산화 상태의 원자를 포함하는 물질은 산화 상태를 높이거나 낮출 수 있습니다. 그들보다, 환원제). 이러한 물질은 산화 환원 이중성을 나타냅니다. 산화 환원 반응의 방정식을 작성할 때 전자 균형 방법과 이온-전자 방법(반쪽 반응 방법)의 두 가지 방법을 사용할 수 있습니다. 용액의 산화 환원 공정에 대한 더 정확한 아이디어는 이온 전자 방법에 의해 제공됩니다. 이 방법의 도움으로 용액에 실제로 존재하는 이온과 분자가 겪는 변화가 예측됩니다. 반응 생성물을 예측하는 것 외에도 이온 반쪽 반응 방정식은 전기분해 및 갈바니 전지에서 발생하는 산화환원 과정을 이해하는 데 필요합니다. 이 방법은 프로세스의 참여자로서 환경의 역할을 반영합니다. 그리고 마지막으로, 이 방법을 사용할 때 많은 물질이 산화환원 반응 방정식을 컴파일하여 얻어지기 때문에 형성된 모든 물질을 미리 알 필요는 없습니다. 반쪽 반응은 산화 환원 반응 동안 발생하는 실제 과정을 반영하지만 산화 환원 반응의 실제 단계(메커니즘)와 동일시될 수 없다는 점을 염두에 두어야 합니다. 많은 요인들이 산화환원 반응의 성질과 방향에 영향을 줍니다: 반응물의 성질, 매질의 반응, 농도, 온도, 촉매. 역학적 요인을 추가로 고려할 필요가 있기 때문에 음수 값이 항상 주어진 방향의 실제 반응 과정에 대한 명확한 결정으로 이어지는 것은 아니라는 점을 염두에 두어야 합니다. 29. 산화 환원 과정의 생물학적 중요성 산화 환원 반응은 한 분자 또는 이온에서 다른 분자 또는 이온으로 전자가 이동하는 화학 과정입니다. 산화 환원 반응에서는 산화와 환원이라는 두 가지 상호 관련된 과정이 발생합니다. 산화는 전자를 잃는 과정입니다. 회복은 전자를 추가하는 과정입니다. 원자 또는 이온이 전자를 제공하는 물질을 환원제라고 합니다. 원자 또는 이온이 전자를 추가하는(또는 공통 전자 쌍을 자체적으로 끌어당기는) 물질을 산화제라고 합니다. 아연과 CuSO의 반응에서4 Cu2 + 전자 추가: 그들 자신2+ + 2이자형- - 시0 . 아연 원자는 전자를 제공합니다. Zn0 -아연2 + 2이자형-. 따라서 CuSO4 - 산화제, Zn - 환원제. 동물 유기체의 중요한 과정은 탄수화물, 지방, 아미노산과 같은 기질 물질의 효소 산화 반응입니다. 이러한 과정의 결과로 유기체는 많은 양의 에너지를 받습니다. 성인 남성의 총 에너지 요구량의 약 90%는 탄수화물과 지방이 산화되는 동안 조직에서 생성되는 에너지로 충당됩니다. 나머지 에너지 ~ ~10%는 아미노산의 산화 분해에 의해 제공됩니다. 생물학적 산화는 많은 수의 효소가 참여하는 복잡한 메커니즘을 통해 진행됩니다. 미토콘드리아에서 산화는 유기 기질로부터의 전자 전달의 결과로 발생합니다. 전자 운반체로서 미토콘드리아의 호흡 사슬에는 전자를 운반하도록 설계된 다양한 작용기를 포함하는 다양한 단백질이 포함됩니다. 한 중간체에서 다른 중간체로 사슬을 따라 이동할 때 전자는 자유 에너지를 잃습니다. 호흡 사슬을 통해 산소로 전달되는 모든 전자 쌍에 대해 3개의 ATP 분자가 합성됩니다. 2개의 전자가 산소로 이동하는 동안 방출되는 자유 에너지는 220kJ/mol입니다. 표준 조건에서 1ATP 분자를 합성하는 데 30,5kJ가 소모됩니다. 이로부터 한 쌍의 전자가 전달되는 동안 방출되는 자유 에너지의 상당 부분이 ATP 분자에 저장되어 있음이 분명합니다. 이 데이터에서 초기 환원제에서 산소로의 다단계 전자 전달의 역할도 분명해집니다. 한 쌍의 전자가 산소로 전달되는 동안 방출되는 큰 에너지(220kJ)는 산화의 개별 단계에 해당하는 여러 부분으로 나뉩니다. 이러한 세 단계에서 방출되는 에너지의 양은 대략 1 ATP 분자 합성에 필요한 에너지에 해당합니다. 산화 환원 반응은 임상 분석에서 Ca 이온, 요산, 카탈라제 및 과산화 효소, 혈액 내 당을 결정하는 데 사용되는 산화 측정법의 기초가 되며, 위생 및 위생 분석에서 물의 산화 가능성, 활성 염소 함량을 결정하는 데 사용됩니다. 표백제, 가정 및 음용수의 잔류 염소. 30. 화학결합과 그 실험적 특성 현대 원자 모델의 개발과 그에 기초한 개별 원자의 특성 예측은 양자역학의 매우 중요한 성과입니다. 그러나 고립된 원자는 지상 조건에서 거의 발견되지 않습니다. 우리 주변의 무생물과 살아있는 자연의 몸은 다양한 분자로 구성되어 있습니다. A. M. Butlerov(1828-1886)는 유기 물질의 화학 구조 이론(1861)을 만들었습니다. 그 이후로 "가"와 "화학 결합"의 개념이 점차 화학에 들어가기 시작했습니다. 원자가는 분자를 형성하기 위해 특정 수의 다른 원자를 부착하는 원자의 능력입니다. 원자가는 요소 기호 옆에 대시로 표시됩니다. 수소(H)는 0가이고 산소(XNUMX= )는 XNUMX가입니다. 원자가 선의 수는 주어진 원자가 다른 원자와 형성할 수 있는 화학 결합의 수를 결정합니다. 화학 결합은 전자와 핵 사이의 일련의 상호 작용으로 원자가 분자로 결합됩니다. 화학 결합의 특성은 다양한 방법으로 연구됩니다. 화학적 방법의 도움으로 원자의 결합 수(가)와 반응성이 결정됩니다. 물리적 방법을 사용하여 화학 결합의 길이, 강도, 방향 및 극성이 결정됩니다. 화학 결합 길이 rс 결합된 원자의 핵 사이의 거리로 측정한 값이라고 합니다. 화학 결합 길이의 단위로 gс 피코미터(pm)를 사용하기 편리함: 오후 1시 = 1012 엠 화학 결합 강도 Eс - 엔탈피 ΔЕ로 측정한 값с 연결 형성. 화학 결합 강도 E의 단위로с kJ/mol이 사용됩니다. 화학 결합 방향с - 주어진 원자와 분자의 이웃 원자 사이의 결합 방향 사이의 각도로 측정한 값. 각도 ac를 원자가 각도라고 합니다. 본드 각도 단위 aс - 도. 화학 결합 극성 μс - 이 연결의 전기적 모멘트에 의해 측정된 값. 절대값이 같고 부호가 반대인 두 전하 +q 및 ־q에 대한 전기 모멘트는 μ = qr과 같습니다. 여기서 r은 전하 사이의 거리입니다. 이 두 전하는 전기 쌍극자를 형성합니다. 전기음성도(EEO)가 다른 두 원자가 결합할 때 화학 결합이 분극화됩니다. 결과적으로 EER이 큰 원자에는 과도한 음전하 δ가 발생하고 EER이 작은 다른 원자에는 과도한 양전하 +δ가 발생합니다. 본드의 극성은 다음 공식으로 계산됩니다. μс = δrс. 화학 결합의 극성을 측정하는 단위로는 오프 시스템 Debye 단위(D) - 1 D = 3,3 x 1030 C/m를 사용하는 것이 편리합니다. 물 분자에서 O-H 결합의 극성은 μ그 = 1,5D. 화학 결합에 대한 연구는 대부분의 경우 다른 화합물에서 동일한 화학 결합의 길이, 강도, 방향, 극성이 거의 동일한 값을 가짐을 보여주었습니다. 따라서 원자 사이에 주어진 결합을 형성하는 상호작용은 서로 다른 분자에서 동일한 성질을 갖는다. 화학 결합의 양자 역학 이론은 이 사실에 대한 설명을 제공합니다. 31. 수소 결합. 분자간 및 분자내 수소 결합 분자의 화학 결합은 일반적으로 매우 강하며 에너지는 100-150 kJ/mol 범위입니다. 또한, 강도가 10-40 kJ/mol인 이른바 수소 결합이 있습니다. 이 채권의 길이는 각각 270-230pm입니다. 원자 E 사이의 수소 결합А 그리고 전자В E에 연결된 수소 원자에 의해 수행되는 상호 작용이라고 함А 또는 전자В 화학 결합. 일반적인 경우 수소 결합의 이미지는 다음과 같은 형식을 갖습니다. ЭА-N...Eв.. 분명히 수소 결합은 3개의 원자가 형성에 참여하기 때문에 XNUMX개의 중심입니다. 그러한 결합이 발생하려면 원자 E가 필요합니다.А 그리고 전자В 높은 전기 음성도를 갖는다. 질소(REO = 3,0), 산소(REO = 3,5), 불소(REO = 4,0) 및 염소(REO = 3,0)와 같은 가장 부정적인 원소의 원자입니다. ls-AO 수소와 두 개의 2pAO 원자 E가 결합하여 수소 결합이 형성됩니다.А 그리고 전자В; 2개의 궤도는 하나의 직선을 따라 배치됩니다. 따라서 수소 결합은 선형입니다. 수소 결합을 다음과 같이 부릅니다. 1) 분자내, 만약 원자 EА 그리고 전자В 이 결합으로 연결된 은 동일한 분자에 속합니다. 2) 분자간, 원자 E인 경우А 그리고 전자В 다른 분자에 있습니다. 분자 내 수소 결합은 예를 들어 고분자 단백질 분자의 나선형 구조를 결정하기 때문에 중요한 생물학적 역할을 합니다. 단백질에서 이들은 아미노산 잔기 사이의 N-H ... O 결합입니다. 똑같이 중요한 것은 분자간 수소 결합입니다. 그들의 도움으로 핵산 사슬이 연결되어 이중 나선을 형성합니다. 핵산 염기 사이에는 NHN과 N-H-O의 두 가지 유형의 결합이 있습니다. 분자의 열 운동의 평균 운동 에너지는 3/2RT 정도입니다. 37°C(310°K)의 인체 온도에서 이것은 약 4kJ/mol입니다. 수소 결합의 강도는 10-40 kJ/mol 범위이므로 주변 분자의 지속적인 충격을 견딜 수 있을 만큼 충분히 강하고 고분자 생물학적 구조의 모양의 불변성을 보장합니다. 동시에 활성 분자의 영향으로 수소 결합이 주기적으로 끊어졌다가 다시 회복되어 다양한 생명 과정의 흐름을 보장합니다. 고려된 예는 VS 방법보다 MO LCAO 방법의 광범위한 적용을 명확하게 보여줍니다. 그럼에도 불구하고 VS 방법은 복잡한 화합물을 포함한 많은 물질의 특성과 구조를 예측하는 데 성공적으로 사용될 수 있습니다. 32. 환경과 인체의 거시적 및 미시적 요소 인체에 포함된 화학 원소에는 다양한 분류가 있습니다. 따라서 V. I. Vernadsky는 살아있는 유기체의 평균 함량 (질량 분율 w, %)에 따라 XNUMX 일 시스템에 따라 요소를 나눴습니다. 이 분류에 따르면, 살아있는 유기체에 포함된 요소는 매크로, 마이크로 및 초미세 요소의 세 그룹으로 나뉩니다. Macronutrients 이들은 신체의 함량이 10보다 높은 요소입니다.2%. 여기에는 산소, 탄소, 수소, 질소, 인, 황, 칼슘, 마그네슘, 나트륨 및 염소가 포함됩니다. 추적 요소 이들은 본문의 내용이 10의 범위에 있는 요소입니다.3 10에5%. 여기에는 요오드, 구리, 비소, 불소, 브롬, 스트론튬, 바륨, 코발트가 포함됩니다. 초미세 원소 이들은 본문의 내용이 10 미만인 요소입니다.5%. 여기에는 수은, 금, 우라늄, 토륨, 라듐 등이 포함됩니다. 현재 초미세 요소는 미량 요소와 하나의 그룹으로 결합됩니다. 이 분류는 생물체에 포함된 원소의 함량만을 반영할 뿐 이 원소의 생물학적 역할과 생리학적 중요성을 나타내는 것은 아닙니다. V. V. Kovalsky는 생명에 대한 중요성에 따라 화학 원소를 세 그룹으로 나눴습니다. 중요한(대체 불가능한) 요소 그들은 인체에 지속적으로 포함되어 있으며 효소, 호르몬 및 비타민의 일부입니다. H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. 그들의 결핍은 정상적인 인간의 삶을 방해합니다. 불순물 원소 동물과 인간의 몸에는 Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. 그들의 생물학적 역할은 거의 이해되지 않거나 알려지지 않았습니다. 불순물 원소 Sc, Tl, In, La, Pr, Sm, W, Re, Tb 등 인간과 동물에서 발견됩니다. 수와 생물학적 역할에 대한 데이터는 아직 명확하지 않습니다. 다양한 세포와 유기체의 구성과 생명 활동에 필요한 요소를 생체 요소라고 합니다. 미량원소의 매우 낮은 농도를 결정하고 생물학적 기능을 확립하는 것이 어렵기 때문에 모든 생물학적 요소를 정확하게 나열하는 것은 여전히 불가능합니다. 24개 요소에 대해 생물학적 특성이 안정적으로 확립되었습니다. 이들은 첫 번째 그룹의 요소와 두 번째 그룹의 일부 요소입니다(Kowalski에 따르면). 33. 인체에서 가장 중요한 생물학적 요소의 지형 인간의 장기는 다양한 화학 원소를 그 자체로 다르게 집중시킵니다. 즉, 미시 및 거시 요소는 서로 다른 장기와 조직 사이에 고르지 않게 분포되어 있습니다. 대부분의 미량 원소는 간, 뼈 및 근육 조직에 축적됩니다. 이 조직은 많은 미량 원소의 주요 저장소(저장소)입니다. 요소는 특정 기관에 대해 특정 친화력을 보일 수 있으며 고농도로 포함되어 있을 수 있습니다. 아연은 췌장에, 요오드는 갑상선에, 불소는 치아 법랑질에, 알루미늄, 비소, 바나듐은 머리카락과 손톱에, 카드뮴, 수은, 몰리브덴은 신장에, 주석은 장 조직, 스트론튬 - 전립선, 뼈 조직, 바륨 - 눈의 색소 망막, 브롬, 망간, 크롬 - 뇌하수체 등 유기체에서 미량 원소는 결합 상태에 있고 자유 이온 형태일 수 있습니다. 뇌 조직의 규소, 알루미늄, 구리, 티타늄은 단백질과 복합체 형태로 존재하는 반면, 망간은 이온 형태로 존재하는 것으로 알려져 있다. 수소와 산소는 다량 영양소입니다. 그들은 성인의 몸에 평균적으로 약 65%를 포함하는 물의 일부입니다. 물은 인간의 장기, 조직 및 체액에 고르지 않게 분포되어 있습니다. 따라서 위액, 타액, 혈장, 림프, 물은 89,5 ~ 90%, 소변, 뇌의 회백질, 신장 - 80%, 뇌의 백질, 간, 피부, 척수, 근육, 폐, 심장 - 70-80%. 무엇보다 최소 40%의 물이 골격에 포함되어 있습니다. 탄소, 수소, 산소, 질소, 황, 인과 같은 다량 영양소는 단백질, 핵산 및 기타 신체의 생물학적 활성 화합물의 일부입니다. 단백질의 탄소 함량은 51-55%, 산소 - 22-24%, 질소 - 15-18%, 수소 - 6,5-7%, 황 - 0,3-2,5%, 인 - 약 0,5%입니다. 탄소, 수소 및 산소도 탄수화물의 일부이며 동물 조직의 함량은 약 2%로 낮습니다. 이러한 요소는 지질(지방)의 일부입니다. 또한 인지질의 구성에는 인산염 그룹 형태의 인이 포함됩니다. 지질은 대부분 뇌(12%), 간(5%), 우유(2-3%), 혈청(0,6%)에 집중되어 있습니다. 그러나 인(600g)의 주요 부분은 뼈 조직에서 발견됩니다. 이것은 인체에 있는 모든 인의 85%입니다. 인은 또한 치아의 단단한 조직에 농축되어 있으며 칼슘, 염소, 하이드록실, 염소, 일반식 Ca의 플루오로아파타이트 형태의 불소와 함께 포함되어 있습니다.5 (포4)3X, 여기서 X는 각각 OH, Cl, F입니다. 칼슘은 주로 뼈와 치아 조직에 집중되어 있습니다. 나트륨과 염소는 주로 세포외액에서 발견되며 칼륨과 마그네슘은 세포내액에서 발견됩니다. 불화물 형태의 나트륨과 칼륨은 뼈와 치아 조직의 일부입니다. 인산 마그네슘으로서의 마그네슘3 (포4)2 치아의 단단한 조직에 들어 있습니다. 호르몬은 신체의 거시 및 미량 요소의 특정 함량을 유지하는 데 관여합니다. 34. 신체에서 화학 원소의 생물학적 역할 인체에서 화학 원소의 생물학적 역할은 매우 다양합니다. 다량 영양소의 주요 기능은 조직을 만들고 일정한 삼투압, 이온 및 산-염기 조성을 유지하는 것입니다. 효소, 호르몬, 비타민, 착화제 또는 활성제로서의 생물학적 활성 물질의 일부인 미량 원소는 신진 대사, 생식 과정, 조직 호흡 및 독성 물질의 중화에 관여합니다. 미량 원소는 조혈, 산화, 환원, 혈관 및 조직의 투과성 과정에 적극적으로 영향을 미칩니다. 칼슘, 인, 불소, 요오드, 알루미늄, 실리콘과 같은 거대 및 미량 원소는 뼈와 치아 조직의 형성을 결정합니다. 다양한 미량 원소의 결핍 또는 과도한 축적과 관련된 많은 질병이 확인되었습니다. 불소 결핍은 충치, 요오드 결핍 - 풍토성 갑상선종, 과도한 몰리브덴 - 풍토성 통풍을 유발합니다. 이러한 패턴은 생체 요소의 최적 농도 균형이 인체에서 유지된다는 사실, 즉 화학적 항상성과 관련이 있습니다. 요소의 부족 또는 과잉으로 인해 이러한 균형을 위반하면 다양한 질병이 발생할 수 있습니다. 탄수화물, 지방, 단백질 및 핵산을 구성하는 유기물(탄소, 수소, 질소, 산소, 황 및 인)과 같은 XNUMX가지 주요 다량 영양소 외에도 무기 다량 영양소(칼슘, 염소, 마그네슘, 칼륨, 나트륨 및 미량 원소) - 구리, 불소, 요오드, 철, 몰리브덴, 아연 및 아마도 (동물에 대해 입증됨), - 셀레늄, 비소, 크롬, 니켈, 규소, 주석, 바나듐. 인체의 미량원소 함량 및 비율 분석은 법의학 검사에도 활용됩니다. 예를 들어, 알코올 중독의 경우 에틸 알코올의 영향으로 간의 칼슘 함량이 증가하고 나트륨과 칼륨이 줄어 듭니다. 동시에 심장과 신장에서는 반대로 칼슘 함량이 감소합니다. 식단에 철, 구리, 불소, 아연, 요오드, 칼슘, 인, 마그네슘 및 기타 요소가 부족하면 인간의 건강에 심각한 결과를 초래할 수 있습니다. 그러나 결핍뿐만 아니라 과도한 생물학적 요소는 화학적 항상성을 방해하기 때문에 신체에 해롭다는 것을 기억해야합니다. 무시할 수 있는 양으로 필수적인 미네랄 성분은 더 높은 농도에서 독성이 됩니다. 많은 요소(은, 수은, 납, 카드뮴 등)는 미량이라도 체내에 들어가면 심각한 병리학적 현상을 일으키기 때문에 독성으로 간주됩니다. 다양한 원소와 그 화합물이 의약품으로 널리 사용됩니다. 따라서 화학 원소의 생물학적 역할에 대한 연구, 이러한 원소와 다른 생물학적 활성 물질(효소, 호르몬, 비타민)의 교환 사이의 관계에 대한 해명은 신약 개발 및 최적의 투여 요법 개발에 기여합니다. 치료 및 예방 목적 모두. 35. S-원소 및 그 화합물 물은 지구상에서 가장 중요하고 널리 퍼진 수소 화합물 중 하나입니다. 물 공간은 지구 표면의 거의 75%를 차지합니다. 성인의 몸에는 평균 65-67%의 물, 태아(4개월)-94%, 신생아-74%가 포함되어 있습니다. 신체의 모든 화학 반응은 수중 환경에서만 발생합니다. 물이 없는 삶은 불가능합니다. 증류수는 약전 제제입니다. 의료 실습에서는 과산화수소 H2 02와 같은 또 다른 수소 화합물이 사용됩니다. 이 화합물은 신진대사의 중요한 부산물입니다. 과산화수소는 무색 투명한 액체입니다. 피부 및 점막과 접촉하면 화상을 일으킴. 분자 H2О2 극선. 산소 원자에 고독한 전자쌍이 존재하면 리간드(전자 수용체)와 과산화수소의 도너-억셉터 결합을 형성할 수 있습니다. H에서 산소의 산화 상태2О2 는 1과 같습니다. 즉, 물(2)과 원소 산소 O의 산화 상태 사이의 중간 값을 가집니다.2 . 이로부터 과산화수소는 산화제의 특성과 환원제의 특성(산화환원 이중성)을 모두 나타낼 수 있다는 결론이 나옵니다. 그러나 표준 산화 환원 반쪽 반응 전위로 판단하면 산화 특성은 과산화수소의 특징입니다. 순수한 과산화수소는 열역학적으로 불안정하며 서 있으면 물과 산소로 폭발적으로 분해되어 많은 양의 열을 방출합니다. 과산화수소 수용액은 더 안정적이며 서늘한 곳에 오랫동안 보관할 수 있습니다. 과산화수소는 일반적으로 30% 수용액인 perhydrol 형태로 판매됩니다. 과산화수소 분해의 공동 과정은 중금속 염의 존재하에 상당히 가속화됩니다. 과산화수소의 금속 이온 촉매 분해는 라디칼의 형성을 유발할 수 있으며, 그 중 가장 중요한 것은 수산화물 HXNUMXO 및 과산화수소입니다. 독성은 다음과 같은 사실에 기인합니다.2О2 그리고 약2 세포막의 지질층과 상호작용하여 세포막을 손상시킵니다. 의료 행위에서 과산화수소는 주로 외부 살균제로 사용됩니다. 액션 H2О2 과산화수소의 산화력과 환원 생성물인 물의 무해성을 기반으로 합니다. 상처를 치료할 때 방출된 산소는 두 가지 역할을 합니다. 1) 항균, 탈취 및 탈색 효과가있어 미생물을 죽입니다. 2) 거품을 형성하여 조직 부패 입자를 부유 상태로 전환하고 상처를 정화합니다. 약전 제제로 3 % 과산화수소 수용액을 사용하고 6 % 과산화수소 용액을 사용하여 모발을 표백합니다. 30% 용액의 형태로 과산화수소는 편평 태선의 사마귀 형태를 치료하고 젊은 사마귀를 제거하는 데 사용됩니다. 36. IA 그룹의 s-원소(리튬, 루비듐, 세슘, 프랑슘)의 생물학적 역할 인체의 함량에 따라 나트륨(0,08%)과 칼륨(0,23%)이 다량영양소이며 나머지 알칼리금속은 리튬(104%), 루비듐(10)5%), 세슘(104%) - 요소를 추적합니다. 리튬 인체의 리튬 함량은 약 70mg(10mmol) - 104%입니다. 고등 동물의 리튬 화합물은 간, 신장, 비장, 폐, 혈액 및 우유에 집중되어 있습니다. 리튬의 최대량은 인간의 근육에서 발견됩니다. 미량 원소로서의 리튬의 생물학적 역할은 아직 완전히 밝혀지지 않았습니다. 세포막 수준에서 Li 이온(충분한 농도)이 세포에 침투할 때 나트륨 이온과 경쟁한다는 것이 입증되었습니다. 분명히, Li 이온에 의한 세포의 Na 이온 교체는 리튬 화합물의 더 큰 공유 원자와 관련이 있으며, 그 결과 인지질에 더 잘 용해됩니다. 일부 리튬 화합물은 조울증 환자에게 긍정적인 영향을 미치는 것으로 확인되었습니다. 위장관에서 흡수된 리튬 이온은 혈액에 축적됩니다. Li 이온의 농도가 0,6mmol/l 이상에 도달하면 정서적 긴장이 감소하고 조울증이 약화됩니다. 동시에 혈장 내 Li 이온 함량을 엄격하게 제어해야 합니다. Li 이온의 농도가 1,6mmol/l를 초과하는 경우 부정적인 현상이 발생할 수 있습니다. 루비듐과 세슘 인체의 루비듐 함량에 따르면 (105%) 및 세슘(10)4%)는 미량 원소에 속합니다. 체내에 지속적으로 함유되어 있지만 생물학적 역할은 아직 밝혀지지 않았습니다. 칼륨의 완전한 유사체인 루비듐은 또한 세포내액에 축적되며 다양한 과정에서 동등한 양의 칼륨을 대체할 수 있습니다. 방사성 동위원소 13rC와 87Rb는 악성 종양의 방사선 요법과 칼륨 대사 연구에 사용됩니다. 빠른 분해로 인해 장기간의 해로운 영향에 대한 두려움 없이 체내에 도입될 수도 있습니다. 프랑스 이것은 인공적인 방법으로 얻은 방사성 화학 원소입니다. 프랑슘이 종양 발달의 초기 단계에서 선택적으로 축적될 수 있다는 증거가 있습니다. 이러한 관찰은 암 진단에 유용할 수 있습니다. 따라서 IA족의 원소 중 Li, Rb, Cs는 생리학적으로 활성이고 Na와 K는 생명적이다. 원자의 전자 구조의 유사성으로 인해 Li와 Na의 물리 화학적 특성의 근접성은 양이온의 생물학적 작용 (세포 외액 축적, 상호 교환 가능성)에서도 나타납니다. 장기간의 원소 양이온의 생물학적 작용의 유사한 성질 - K+, Rb+, CS+ (세포내액 축적, 상호교환성)은 또한 전자 구조 및 물리화학적 특성의 유사성 때문입니다. 이것은 리튬 및 루비듐 염 중독의 경우 나트륨 및 칼륨 제제 사용의 기초입니다. 37. IA 그룹의 s-요소(나트륨, 칼륨)의 생물학적 역할 체중이 70kg인 인체의 나트륨 함량은 약 60g(2610mmol) - 0,08%입니다. 이 중 나트륨의 44%는 세포외액에, 9%는 세포내액에 있습니다. 나머지 나트륨은 체내에서 Na 이온이 침착되는 뼈 조직에 있습니다. 뼈 조직에 함유된 나트륨의 약 40%는 대사 과정에 관여하며, 이로 인해 골격은 Na 이온의 기증자 또는 수용체가 되어 세포외액의 Na 이온 농도를 일정하게 유지하는 데 도움을 줍니다. 나트륨은 주요 세포 외 이온입니다. 인체에서 나트륨은 주로 염화물, 인산염 및 탄산수소염과 같은 용해성 염의 형태입니다. 나트륨은 혈청, 뇌척수액, 눈액, 소화액, 담즙, 신장, 피부, 뼈 조직, 폐, 뇌 등 전신에 분포합니다. Na 이온은 인체 내부 환경의 불변성을 보장하는 중요한 역할을 하며, 생체 유체의 일정한 삼투압 유지(삼투 항상성)에 관여합니다. Na 이온은 물 대사 조절에 관여하고 효소의 기능에 영향을 미칩니다. K, Mg, Ca, Cl 이온과 함께 Na 이온은 신경 자극의 전달에 관여하고 근육 세포의 정상적인 흥분성을 유지합니다. 신체의 나트륨 함량이 변하면 신경계, 심혈관 및 기타 시스템의 기능 장애, 평활근 및 골격근이 발생합니다. 염화나트륨 NaCl은 위액 염산의 주요 공급원입니다. 나트륨은 주로 식염의 형태로 인체에 들어갑니다. 나트륨에 대한 신체의 실제 일일 필요량은 1g이지만 이 요소의 평균 섭취량은 4-7g에 이릅니다. NaCl의 지속적인 과잉 섭취는 고혈압에 기여합니다. 미생물 세포에 대한 알칼리의 영향으로 세포 단백질의 침전이 발생하여 결과적으로 미생물이 사망합니다. 황산나트륨(Glauber's salt) Na2SO4 × 10H2O는 완하제로 사용됩니다. 사붕산나트륨 Na2B4О7 × 10H2O는 외부에서 헹굼, 세척, 윤활을 위한 방부제로 사용됩니다. 10% 용액 형태의 수산화나트륨은 코발트-크롬 합금으로 주조 보철물을 제조할 때 내화 모델을 주조하기 위해 정형외과에서 사용되는 실린의 일부입니다. 체중 70kg의 인체에서 칼륨의 함량은 약 160g(4090mmol) - 0,23%입니다. 칼륨은 활성 세포 양이온 총 수의 2/3를 차지하는 주요 세포 내 양이온입니다. 체내에 함유된 칼륨의 총량 중 98%는 세포 내부에 있으며 약 2%만이 세포 외액에 있습니다. 칼륨은 몸 전체에 분포되어 있습니다. 지형 : 간, 신장, 심장, 뼈 조직, 근육, 혈액, 뇌 등 K 이온은 근육 수축, 심장의 정상적인 기능, 신경 자극 전도, 대사 반응과 같은 생리적 과정에서 중요한 역할을합니다. K 이온은 세포 내부에 위치한 효소의 중요한 활성제입니다. 38. IIA 그룹의 s-요소의 생물학적 역할. 의학에서의 사용(베릴륨, 마그네슘, 칼슘) 베릴륨은 동물뿐만 아니라 식물에서도 발견됩니다. 살아있는 유기체의 베릴륨 함량은 107%, 즉 불순물 초미세 원소입니다. 베릴륨의 생물학적 역할은 충분히 연구되지 않았습니다. 베릴륨 화합물은 독성이 있으며 여러 질병(베릴륨 구루병, 베릴륨증 등)을 일으킵니다. 베릴륨의 휘발성 화합물은 특히 유독합니다. 생리적 과정에 대한 Be2 +의 부정적인 영향은 화학적 특성으로 설명됩니다. 마그네슘은 공식적으로 다량 영양소입니다. 체내 총 함량은 0,027%(약 20g)입니다. 인체에서 마그네슘의 지형은 다음과 같습니다. 마그네슘은 상아질과 치아 법랑질, 뼈 조직에 가장 많이 집중되어 있습니다. 또한 췌장, 골격근, 신장, 뇌, 간 및 심장에 축적됩니다. 성인의 경우 마그네슘의 일일 요구량은 약 0,7g이며 Mg 이온은 K 이온과 마찬가지로 세포 내 양이온입니다. 신체의 생물학적 체액과 조직에서 마그네슘은 아쿠아 이온의 형태와 10 미만의 양으로 단백질이 결합된 상태로 발견됩니다.2%, 즉 본질적으로 이것은 미량 요소입니다. 세포 내부의 Mg 이온 농도는 세포 외액보다 약 2,5-3배 높습니다. 마그네슘 이온은 인체에서 중요한 생물학적 역할을 합니다. Mg의 더 작은 이온 반경과 더 높은 이온화 에너지로 인해2+ Ca 이온보다 더 강한 결합을 형성하므로 효소 공정에 더 활성인 촉매입니다. 다양한 효소 시스템의 일부인 Mg 이온은 필수적인 구성 요소이자 활성제입니다(카르복시펩티다제, 콜린에스테라제 및 일부 다른 효소는 Mg 이온에 특이함). 많은 효소 반응과 관련된 ATP의 가수분해는 HPO2가 형성되고 많은 양의 에너지가 방출되는 결과로 과량의 Mg로 발생합니다.2+. 칼슘은 다량 영양소입니다. 체내 총 함량은 1,4%입니다. 칼슘은 인체의 모든 세포에서 발견됩니다. 칼슘의 대부분은 뼈와 치아 조직에서 발견됩니다. 성인은 하루 평균 1g의 칼슘을 섭취해야 하지만 필요한 칼슘은 0,5g에 불과하며 음식과 함께 섭취한 칼슘은 장에서 흡수되는 비율이 50%에 불과합니다. 상대적으로 낮은 흡수는 위장관에서 난용성 인산칼슘 Ca의 형성의 결과입니다.3(포4)2 및 지방산의 칼슘 염을 포함한다. 체내에서 Ca 이온의 농도는 호르몬에 의해 조절됩니다. 성인의 뼈와 치아에는 약 1kg의 칼슘이 불용성 결정질 광물인 하이드록시아파타이트 Ca 형태로 존재합니다.10(로4)6(그)2 , Ca 이온과 인산염의 상호 작용 중에 형성됩니다. 혈액과 림프에서 칼슘은 단백질, 탄수화물 등의 화합물에서 이온화 및 비이온화 상태로 발견됩니다. 혈액 응고 메커니즘은 이온화 Ca의 존재 여부에 따라 여러 단계로 구성됩니다. Ca 이온은 신경 자극 전달, 근육 수축, 심장 근육 조절에 관여합니다. 세포 내부와 외부의 Ca 이온 농도는 각각 106 및 (2,25-2,8) 103 정부. 칼슘은 실제로 세포 내부에서 사용되지 않기 때문에 뼈, 치아와 같은 신체의 건축 자재 역할을 합니다. 골격은 신체의 주요 칼슘 저장고입니다. 39. VIB 그룹의 d-요소의 생물학적 역할. 의학에서의 사용 크롬은 식물 및 동물 유기체에서 발견됩니다. 성인의 몸에는 약 6g의 Cr(0,1%)이 포함되어 있습니다. 크롬 금속은 독성이 없지만 Cr(III) 및 Cr(VI) 화합물은 건강에 유해합니다. 그들은 피부염을 유발하는 피부 자극을 유발합니다. 크롬(VI)의 파생물이 발암성을 가지고 있다는 가정이 있습니다. 0,25~0,3g의 중크롬산칼륨은 사망을 유발합니다. 크롬(VI) 화합물은 살균제로 사용됩니다(세척제, 곰팡이 - "버섯", 칼데레 - "살해"). 크롬(III) 화합물은 식물 성장에 유익한 효과가 있습니다. 몰리브덴은 가장 중요한 생체 요소 중 하나인 "생명의 금속"에 속합니다. 그것의 특별한 위치는 20-25년 전에 F. Krin과 L. Oril에 의해 언급되었습니다. 이 과학자들은 지구상의 생명체의 출현이 진화에 의해 발생한 것이 아니라 우리보다 오래 전에 생명체가 존재했던 몰리브덴 별의 우주에서 온 미지의 문명에 의해 발생했다는 아이디어를 제시했습니다. 생화학 공정에서 몰리브덴은 VI와 VI의 산화 상태에 관여합니다. 이러한 상태에서 안정적인 옥소 형태를 만듭니다. 몰리브덴은 안정적인 옥소 복합체를 형성하므로 분명히 옥소 그룹의 전달을 보장하는 효소의 일부입니다. Mo(VI)는 혈액에서 우세합니다. 리간드가 산소이면 안정한 isopolymolybdations가 형성됩니다. 음식의 과도한 몰리브덴 함량은 Ca 대사를 방해합니다.2+ 및 RO4 , 골강도 감소 - 골다공증. 아마도 인몰리브덴 착물에 결합이 일어날 것입니다. 이러한 복합체는 헤테로폴리몰리브덴산의 산 잔기로 간주될 수 있습니다. 칼슘을 사용하면 이러한 잔류물이 불용성 결정을 형성합니다. 이러한 결정이 요산 염의 침착을 시작하여 통풍을 유발할 가능성이 있습니다. 통풍은 관절을 변형시켜 "발 함정"이라는 문자 그대로의 번역을 정당화합니다. 산소 착물 외에도 몰리브덴은 할로겐화물(Hal), 티오시아네이트(NCS) 및 시안화물(CN) 착물을 형성합니다. 몰리브덴은 다양한 효소의 구성 성분입니다. 인체에는 알데히드 수산화효소, 크산틴 탈수소효소 및 크산틴 산화효소가 포함됩니다. 잔틴 산화효소(COX)의 분자량은 250 a.u입니다. e.m. 이것은 포유류의 몰리브덴 함유 효소입니다. 크산틴 및 기타 퓨린과 알데히드의 산화를 촉매할 수 있습니다. 하이포크산틴과 크산틴의 요산으로의 전환은 크산틴 산화효소에 의해 촉매됩니다. 촉매 과정에서 몰리브덴은 크산틴의 질소 및 산소와 결합을 형성한다고 가정합니다. 몰리브덴은 참여하는 생물학적 활성 물질이 온화한 질소 고정을 제공하기 때문에 식물의 가장 중요한 미량 원소입니다. 그들은 그것을 암모니아 또는 질소 함유 제품으로 변환합니다. 다른 산업적으로 중요한 금속에 비해 몰리브덴은 독성이 낮습니다. 음식과 함께 몰리브덴의 소비량은 0,1 - 0,3 mg / day이지만 필요한 일일 섭취량은 확립되지 않았습니다. 몰리브덴 결핍은 조직에서 크산틴 산화효소 활성을 감소시킵니다. 몰리브덴의 과도한 함량은 골다공증을 유발합니다. 텅스텐은 미량 원소입니다. 신체에서의 역할은 잘 알려져 있지 않습니다. 텅스텐의 음이온 형태는 위장관에서 쉽게 흡수됩니다. 금속 텅스텐과 그 양이온 형태는 체내에 흡수되지 않습니다. 포유류의 텅스텐 항상성에 대한 정보는 없습니다. 40. 망간 화합물의 생물학적 역할. 의학에서의 사용 VIIB 족의 원소 중 망간만이 생물학적 원소이며 살아있는 유기체의 정상적인 과정에 필요한 XNUMX가지 "생명의 금속" 중 하나입니다. 성인의 몸에는 12mg이 들어 있습니다. 망간은 뼈(43%)에 집중되어 있고 나머지는 뇌를 포함한 연조직에 집중되어 있습니다. 신체에서 망간은 단백질, 핵산, ATP, ADP, 개별 아미노산과 금속 착물을 형성합니다. 망간 금속효소 아르기나제, 콜린에스테라제, 포스포글루코뮤타제, 피루브산 카르복실라제를 함유합니다. 포유류의 몸에서 아미노산 변형의 독성 생성물 인 암모니아의 결합은 아미노산 아르기닌을 통해 수행됩니다. 아르기나아제는 간에서 아르기닌의 가수분해를 촉매하는 효소입니다. 결과적으로 아르기닌은 요소와 사이클릭 아미노산 오르니틴으로 분해됩니다. 요소는 독성이 없는 수용성 물질입니다. 혈류를 통해 신장으로 운반되어 소변으로 배설됩니다. 망간의 원자 반지름은 128pm입니다. 이것은 망간이 ATP와 결합하여 마그네슘(원자 반경 160pm)을 대체할 수 있다는 사실을 설명하여 신체의 에너지 전달에 상당한 영향을 미칩니다. Mg 및 Mn 이온은 또한 효소인 뉴클레아제의 활성화를 수행합니다. 이 효소는 십이지장에서 DNA 및 RNA 핵산의 가수분해를 촉매합니다. 결과적으로 이러한 생체 고분자는 단량체 단위인 뉴클레오티드로 나뉩니다. 특히, 이러한 뉴클레아제는 데옥시리보뉴클레아제로, Mg 존재하에서만 DNA 가수분해를 촉매한다.2+ 또는 MP2+. 망간은 또한 신체의 무기 화합물의 일부일 수 있습니다. 예를 들어, 이것은 난용성 망간 마그네슘 피로포스페이트 MnMgP입니다.2O7. 이 염의 결정은 소포막의 내부 표면에 국한되어 있습니다. 망간과 철의 원자 반경의 거의 동일한 값은 적혈구 포르피린 복합체에서 철을 대체하는 망간의 능력을 설명합니다. 같은 이유로 망간은 아연 의존성 효소에서 아연을 대체하여 촉매 특성을 변화시킬 수 있습니다. 과망간산칼륨 KMnO4 - 의학에서 사용되는 가장 유명한 망간 화합물. KMnO가 포함된 수용액 사용4 0,01-5%. 5% 용액을 지혈제로 사용합니다. 과망간산 칼륨 용액은 높은 산화력에 의해 결정되는 방부성을 가지고 있습니다. 다른 망간 화합물 중에서 빈혈 치료에 사용되는 황산망간(II)과 염화망간(II)에 주목해야 합니다. 살아있는 유기체에서 테크네튬의 존재에 대한 데이터는 없습니다. 그러나 비스포스포네이트와 테크네튬 화합물은 방사성 동위원소 진단 방법으로 사용됩니다. 41. 철 화합물의 생물학적 역할. 헤모글로빈 철은 동식물의 조직에서 발견되는 생물학적 요소입니다. 성인의 몸에 있는 철의 총 질량은 약 5g으로 0,007%입니다. 금속 철은 독성이 낮고 Fe(II), Fe(III) 및 Fe(VI) 화합물이 대량으로 있으면 건강에 해롭습니다. 미오글로빈, 시토크롬, 카탈라아제는 세포 호흡을 제공합니다. 이 모든 단백질은 자체 단백질 부분과 관련 활성 센터로 구성됩니다. 활성 센터는 거대고리 복합 화합물인 헴입니다. 화합물 포르피린은 거대고리 리간드로 작용합니다. 기증자 질소 원자는 정사각형의 모서리에 있으며 그 중심에는 Fe 이온이 있습니다. 일반적으로 복합 단지에는 팔면체 구성이 있습니다. 아미노산의 질소를 통한 XNUMX번째 오비탈(히스티딘)은 헴을 단백질에 결합시키는 데 사용된다. 헤모글로빈은 단일 거대분자 집합체를 형성하는 4개의 단백질 분자(서브유닛)로 구성됩니다. 각 소단위는 미오글로빈 분자와 구조가 유사합니다. 따라서 헤모글로빈은 XNUMX개의 O 분자와 동시에 결합할 수 있습니다.2 , 미오글로빈 - 1. 또한 조직에는 여러 가지 비-헴 철 함유 단백질 복합체가 있습니다. 예를 들어 효소 - 산화 효소, 단백질 - 저장 (창고) 및 철 운반체입니다. 과잉 철분은 단백질 트랜스페린에 의해 혈액으로 운반되어 다양한 조직과 기관, 특히 간, 비장 및 골수에 페리틴 단백질 형태로 축적됩니다. 페리틴은 직경이 24-12 nm인 구를 형성하는 14개의 단백질 분자(하위 단위)로 구성됩니다. 각 소단위는 최대 7개의 철 원자를 포함하는 직경 4500nm의 공동을 포함합니다. 따라서 각 페리틴 응집체는 약 100개의 철 원자를 저장할 수 있으며 이 요소와 관련된 수많은 대사 반응을 제공합니다. 화학 평형 법칙에 기초하여 폐에서 조직으로의 산소 운반체로서의 헤모글로빈의 기능을 이해하는 것은 어렵지 않습니다. 산소가 없는 헤모글로빈(deoxyhemoglobin)은 약산이며 화학식은 HHb로 나타낼 수 있습니다.+. 산소의 추가는 양성자의 제거를 동반하고 산소 헤모글로빈 HbO가 형성됩니다.2 . 이 경우 균형이 있습니다. HHb+ + O2 → HBO2 + 엔+. 산소가 부족한 정맥혈이 산소 분압이 높은 폐(최대 20kPa)로 들어가면 헨리의 법칙에 따라 용해도가 증가합니다. 이것은 Le Chatelier의 원리에 따라 평형이 오른쪽으로 이동하고 산소 헤모글로빈이 형성됩니다. 평형이 오른쪽으로 추가로 이동하는 것은 폐에서 pH 값이 증가하기 때문입니다(최대 7,5). 결과적으로, 폐에서 데옥시헤모글로빈은 산소로 거의 완전히(최대 97%) 포화되어 산소 헤모글로빈으로 전달됩니다. 말초조직을 관통하는 모세혈관에서 산소분압은 5kPa로 감소하고 pH값은 7,2로 감소한다. 결과적으로 균형은 왼쪽으로 이동합니다. 말초에서 흐르는 혈액에서 헤모글로빈은 산소로 65%만 포화됩니다. 42. 철 화합물의 생물학적 역할. CO 일산화탄소. 헴 함유 단백질의 금속 복합체 특성은 CO(일산화탄소) 및 MCN(시안화물 - 시안화 수소산 염)과 같은 독성 물질의 작용으로 나타납니다. 생리학적 관점에서 가장 중요한 것은 헤모글로빈, 미오글로빈, 사이토크롬, 과산화효소, 카탈라아제와 같은 철 함유 단백질입니다. 적혈구의 주성분인 헤모글로빈은 폐에서 조직으로 산소를 운반하는 외부 호흡을 제공합니다. 철 Fe와 코발트 Co는 살아있는 유기체의 필수 미량 원소입니다. 일산화탄소 CO는 연료의 불완전 연소 생성물 중 하나입니다. 이 가스의 상당량은 보일러, 내연 기관 및 흡연 중에 배출됩니다. 산소 헤모글로빈 HbO와 병행하여 폐의 공기와 함께 CO를 흡입할 때2 금속 착물 화합물이 형성됩니다-카르보닐 헤모글로빈 HbCO. HbCO의 안정성 상수는 HbO의 약 200배입니다.2 . 따라서 소량의 CO라도 상당한 비율의 디옥시헤모글로빈을 "차단"하여 결과적으로 장기에 산소 공급이 감소합니다. 저산소증 - 산소 결핍의 징후가 있습니다. 신경 조직이 가장 먼저 영향을 받습니다. 일산화탄소의 해독 (독성 효과 제거)을 위해 많은 경우 공급을 중단하고 산소 환기를 증가시키는 것으로 충분합니다. 피해자를 신선한 공기로 데려가십시오. 이 경우 Le Chatelier의 원리가 다시 작동합니다. 평형은 옥시 헤모글로빈 형성으로 이동합니다. 고농도에서 일산화탄소는 세포 호흡의 헴 함유 단백질을 차단하고 치명적인 결과를 피하기 어렵습니다. 시안화물의 작용 메커니즘은 유사하지만 독성은 CO보다 높습니다. 이러한 물질이 아주 소량이라도 혈액에 들어가면 호흡 정지 및 사망에 이를 수 있습니다. 시안화물의 높은 독성은 시안화물 헤모글로빈의 더 큰 안정성을 결정하는 Fe-CN- 결합의 높은 강도로 설명됩니다. 산소 호흡은 과산화수소 H를 형성합니다.2O2 . 이 물질은 높은 산화력을 가지고 있습니다. 그것이 세포의 생물 유기 화합물과 상호 작용할 때 라디칼이 형성됩니다. 불포화 원자가를 가진 매우 활동적인 분자 입자와 과산화물 산화가 시작됩니다. 라디칼의 영향으로 세포막과 DNA의 가장 중요한 구성 요소가 파괴됩니다. 생물학적 진화 과정에서 자연은 과산화수소를 파괴하는 효소 카탈라아제라는 특수 단백질을 개발했습니다. 이것은 이 물질의 과도한 축적을 제한하고 세포의 파괴를 방지합니다. 카탈라아제(CatFe2+ )는 두 개의 연속적인 반응의 촉매 주기로 나타낼 수 있습니다. 고양이2+ + 엔2O2 - 고양이 페2+ × 높이2O2 , 고양이2+ × 높이2O2 + 엔2O2 → 캣페2+ + 2시간2O2 + O2 . 결과적으로 2개의 과산화수소 분자가 파괴되고 CatFe2+ 생체 촉매 분자가 방출되어 다음 촉매 주기에 들어갈 수 있습니다. 이 과정은 매우 빠릅니다. 1초 안에 20개의 카탈라아제 분자는 최대 000번의 주기를 수행할 수 있습니다. 43. 철과 코발트 화합물의 생물학적 역할 신체에 철분이 부족하면 질병이 발생할 수 있습니다 - 철분 결핍 빈혈 (빈혈). 헤모글로빈 합성을 위한 철 결핍과 관련된 조직 산소 결핍이 있습니다. 결과적으로 말초 장기로의 산소 전달이 감소하고 이에 따라 세포 호흡 수준이 감소하고 신진 대사가 느려집니다. 약물로 염화철(II) 또는 황산철(II)을 도입하면 질병의 중증도가 감소합니다. 같은 목적으로 위액의 염산에 쉽게 용해되는 금속성 철의 미분말(환원철, 1회 XNUMXg까지)을 사용한다. 따라서 이 약의 작용은 염화철(II)의 작용과 유사하다. 그러나 철과 설탕, 니코틴아미드 및 기타 유기 물질의 생체 무기 복합체인 약물이 더 효과적입니다. 이러한 복합체는 혈액에 잘 흡수되어 약리학 적 효과가 있습니다. 흥미로운 사실은 고대부터 현재까지 이른바 철분 와인이 철분 결핍성 빈혈을 치료하는 데 사용된다는 것입니다. 분명히 철분은 와인 (산성 환경)에 용해되어 대량으로 포함되어있는 천연 유기 물질과 복합체를 형성합니다. 고대 음료의 작용 메커니즘은 현대 약물의 메커니즘과 거의 동일하다는 것이 분명합니다. 철과 마찬가지로 코발트도 가장 중요한 생물학적 요소 중 하나입니다. 성인의 몸에 있는 코발트의 총 질량은 약 1,2mg으로 10% 미만입니다. 이 덩어리의 약 100mg은 시아노코발라민(지용성 비타민 B12 ) 및 그 유사체. 이 물질은 헴과 마찬가지로 거대고리 복합화합물입니다. XNUMX자리 화합물인 포르핀은 거대고리 리간드로 작용합니다. R은 복합 유기 치환체이다. 시아노코발라민의 유사체에서는 CN 음이온 대신 다양한 유기 치환체가 작용합니다. 비타민 B의 가장 중요한 역할12 적혈구(적혈구 생성)의 발달과 형성에 관여합니다. 비타민 B 결핍12 (하루 3mcg 미만 섭취) 심각한 질병 - 악성 빈혈 (빈혈)로 이어집니다. cyanocobalamin의 유사체가 적혈구 생성에 관여하는 다양한 효소의 보조 인자인 활성제인 것으로 확인되었습니다. 보조 인자의 부족은 헤모글로빈과 적혈구의 결핍에서 나타납니다. 식물과 동물은 비타민 B를 합성할 수 없습니다12. 특정 유형의 박테리아에 의해서만 생성됩니다. 이 박테리아는 인간의 위장관에 존재합니다. 그들은 충분한 비타민 B를 합성합니다.12. 악성 빈혈은 이 비타민의 혈액 내 흡수 장애와 관련이 있습니다. 따라서 약을 복용하는 것은 효과가 없습니다. 혈액에 비타민(100일 동안 200-2mcg)을 주사하면 악성 빈혈이 있는 환자의 상태가 크게 개선됩니다. 44. IB 그룹의 d-요소의 역할. 의학에서 화합물의 사용 구리 Cu는 살아있는 유기체의 필수 미량 원소입니다. 은 Ag 및 금 Au는 불순물 미량 원소입니다. 그들의 화합물은 의학에 사용됩니다. 구리는 동물과 식물의 조직에서 발견되는 생체 요소입니다. 성인의 체내 구리 총 질량은 약 100mg으로 약 0,0001%입니다. 이 양의 약 30%는 근육에서 발견됩니다. 간과 뇌에도 구리가 풍부합니다. 금속성 구리와 그 화합물은 독성이 있습니다. 생리학적 관점에서 가장 중요한 것은 구리 함유 단백질인 사이토크롬 산화효소와 슈퍼옥사이드 디스뮤타아제입니다. 시토크롬 산화효소는 미토콘드리아 막에 국한된 호흡 사슬의 구성 요소 중 하나입니다. 호흡 사슬의 끝에서 산소를 물로 환원시켜 세포 호흡을 제공합니다. 신체는 매일 2,5-5,0mg의 구리를 필요로 합니다. 신체에 구리가 부족하면 구리 결핍 빈혈과 같은 질병이 발생할 수 있습니다. 구리는 철의 흡수, 특히 철과 구리를 모두 포함하는 시토크롬 산화효소의 합성에 필요합니다. 구리 결핍으로 결합 조직과 혈관의 정상적인 발달이 방해받습니다. 중독은 일반적으로 살충제의 우발적 과다 복용, 금속 분말 흡입, 구리 염 용액 섭취와 관련이 있습니다. 벽의 보호 코팅 없이 구리 용기에 저장된 음료는 매우 위험합니다. 외제로는 0,25% 황산구리 CuSO 수용액을 사용한다.4 점막의 염증과 결막염. 이 약의 소량은 음식과 함께 복용하여 빈혈의 적혈구 생성을 증가시킬 수 있습니다. 은과 금 성인의 몸에는 약 1mg의 은, 즉 약 10%(1ppm)가 발견되고 최대 10mg의 금, 즉 약 10%(10ppm)가 발견됩니다. 가용성 은염의 방부성은 고대부터 알려져 왔습니다. 사제들은 물("거룩한")을 은그릇에 보관하면 오랫동안 변질되지 않는다는 것, 즉 미생물에 오염되지 않는다는 사실을 오래전부터 알고 있었습니다. 현재이 "은색"물의 속성은 장거리 항해의 선원들이 사용합니다. AgNO 7g을 섭취하면 성인에서 강한 독성 발현이 관찰됩니다.3. 의학에서는 결정질 질산은 AgNO03(청금석) 및 그 수용액과 같은 약물이 오랫동안 사용되어 왔습니다. 콜로이드성 금속 은 제제 protargol(8% Ag) 및 collargol(70% Ag)은 금속 광택이 있는 미세 분말인 것으로 오랫동안 알려져 왔습니다. 이러한 분말의 각 입자는 알부민(protargol) 또는 콜라겐(collargol)의 단백질 껍질을 가진 크기가 1μm 미만인 환원된 금속 은의 결정입니다. 단백질 껍질은 은 결정이 서로 달라붙는 것을 방지하고 수성 매질로의 전이를 보장합니다(가용화). 은 제제는 항염증제, 방부제 및 수렴제로 사용됩니다. 금 제제는 효과적인 항염증제로도 사용됩니다. 가장 잘 알려진 것은 귀금속 함량이 30%인 krizanol과 콜로이드 금입니다. 45. 그룹 IIB의 d-요소의 생물학적 역할. 의학에서 화합물의 사용 아연 Zn, 카드뮴 Cd, 수은 Hg는 미량 원소입니다. 성인의 몸에는 1,8g의 Zn, 50mg의 Cd, 13mg의 Hg가 포함되어 있습니다. 카드뮴과 수은은 불순물 원소입니다. 수은의 약 70%는 지방과 근육 조직에 집중되어 있습니다. 카드뮴은 신장에 30%, 나머지는 간, 폐, 췌장에 국한되어 있습니다. 아연은 모든 식물과 동물에게 필수적인 요소입니다. 성인의 몸에서 대부분의 아연은 근육(65%)과 뼈(20%)에 있습니다. 나머지 양은 혈장, 간, 적혈구에 떨어집니다. 전립선에서 아연 농도가 가장 높습니다. 아연은 가변 원자가를 나타내지 않습니다. 따라서 분명히 생체 복합체는 전자 전달 없이 발생하는 많은 생화학적 가수분해 반응에 참여합니다. Zn 이온은 에스테르와 단백질의 가수분해를 촉매하는 40개 이상의 금속효소의 일부입니다. 가장 많이 연구된 것 중 하나는 약 30개의 아미노산 잔기로 구성된 탄산탈수효소(Mg = 000)인 생체무기 아연 복합체입니다. 아연은 디펩티드(2개의 아미노산으로 구성된 물질)의 가수분해를 촉매하는 효소인 디펩티다아제의 일부가 아닙니다. 아연은 혈당을 조절하는 호르몬인 인슐린과 함께 생체 무기 복합체를 형성합니다. 아연에 대한 인간의 필요는 육류, 유제품, 계란과 같은 식품으로 완전히 충족됩니다. 식물에 아연이 부족하면 단백질과 탄수화물 대사가 방해 받고 엽록소와 비타민의 합성이 억제됩니다. 아연 결핍은 아연 함유 비료를 사용하여 제거됩니다. 그룹 IIB 화합물의 독성은 아연에서 수은으로 증가합니다. 수용성 화합물은 피부를 자극하고 섭취할 경우 중독을 일으킵니다. 금속 자체도 독성이 있습니다. 아연 증기 (아연 생산 공기)를 흡입하면 "금속"열이 나타납니다. 중세 시대의 수은 증기 중독은 "미친 모자 장수병"이라고 불렸습니다. 식품(일본과 같은 해양)의 수은 함량은 미노마타병을 유발합니다. 수은 독성은 적혈구의 응집(함께 달라붙음), 효소 억제와 관련이 있습니다. 예를 들어 승화는 모세 혈관을 통한 이동에 필요한 적혈구의 크기 변화, 삼투압 취약성 및 변형 가능성 감소를 유발합니다. 카드뮴의 독성은 핵산에 대한 친화성과 관련이 있습니다. DNA에 부착된 결과 기능이 중단됩니다. 만성 카드뮴 및 수은 독성은 뼈의 무기질화를 손상시킬 수 있습니다. 독성 요소는 칼슘을 대체할 수 있습니다. 이것은 뼈 조직의 결정질 구성 요소의 매개 변수가 왜곡되어 불완전한 구조의 인회석을 형성합니다. 결과적으로 뼈의 강도가 감소합니다. 46. IIB족 화합물의 독성 특성(Zn, Cd, Hg) 화합물 Zn, Cd, Hg는 단백질 대사를 위반할 수 있으며, 이는 신장을 통한 혈장 단백질 방출(단백뇨)에서 나타납니다. 신체에 대한 IIB 그룹 화합물의 독성 효과는 이러한 금속 이온이 단백질, 효소 및 아미노산의 sulfhydryl SH 그룹과 상호 작용하기 때문에 발생합니다. 금속 이온이 SH 그룹과 상호 작용하면 약하게 해리되고 일반적으로 불용성 화합물이 형성됩니다. 따라서 sulfhydryl 그룹의 차단은 효소 활성 및 단백질 폴딩의 억제로 이어집니다. XNUMX가 금속 이온은 두 개의 SH 그룹을 동시에 차단합니다. 이러한 유형의 반응에서 금속 이온은 억셉터 역할을 하고 황은 전자 공여체 역할을 합니다. 수은에서 SH 그룹에 대한 가장 뚜렷한 화학적 친화력. 분명히 이것은 수은의 착화 특성이 더 높고 황과 더 강한 결합을 형성하기 때문입니다. SH 그룹은 100개 이상의 효소의 일부이며 이들 그룹의 차단으로 인해 활성이 억제될 수 있습니다. 따라서 금속으로 신체를 중독시키는 차단 메커니즘과 치료 방법을 아는 것이 얼마나 중요한지 알 수 있습니다. 원소의 독성 특성은 신체에 들어가는 화학적 형태에 따라 달라집니다. 가장 유독한 형태는 지질에 용해되고 막을 통해 세포로 쉽게 침투하는 형태입니다. 문헌은 일본의 대량 수은 중독 사례를 설명합니다. 무기 수은 화합물은 미생물 효소의 작용으로 메틸수은으로 전환되었습니다. 메틸수은은 물고기에 축적되어 음식과 함께 인체에 들어갔습니다. 점차적으로 농축되는 메틸수은은 신체에 돌이킬 수 없는 파괴와 죽음을 초래합니다. 의학에서 아연 및 수은 화합물의 사용은 수렴, 소작 및 방부 효과를 기반으로 합니다. 점안액으로 황산아연 ZnSO의 0,25% 수용액이 사용됩니다.4. 치과에서 염화아연은 유두종을 소작하고 염증이 있는 점막을 치료하는 데 사용됩니다. 산화아연 ZnO도 사용됩니다. 염화수은(II)염화수은(염화수은)은 독성이 매우 강하여 고희석(1:1000)의 수용액을 소독용으로 사용합니다. 피부 및 성병 치료를 위해 수은 산화물 (II) HgO 및 수은 황화물 (II) HgS를 포함하는 연고가 사용됩니다. 염화수은(I)(칼로멜)은 물에 잘 녹지 않으므로 약간 독성이 있습니다. 이 소금은 수의학에서 완하제로 사용됩니다. 정상적인 조건에서 수은은 다른 금속을 용해할 수 있는 액체 금속입니다. 이 경우 경질 합금(아말감)이 형성됩니다. 치과에서 은과 카드뮴 아말감은 오랫동안 치아를 채우는 데 사용되었습니다. 그들은 화학적으로 불활성이며 가열되면 쉽게 부드러워지기 때문에 성형하기 쉽습니다. 자외선 광원(의료용 수은 석영 램프)에는 기체 수은(증기)이 포함되어 있습니다. 병실에서 이 램프의 빛을 비추면 공기 중에 포함된 미생물이 파괴됩니다. 자외선의 도움으로 다양한 피부 질환을 치료합니다. 따라서 기능 및 신체에 미치는 영향의 특성에 따라 IIB 그룹의 금속은 필수 원소 Zn과 독성 불순물 원소 Cd 및 Hg로 나눌 수 있습니다. 47. IIIA군 p-요소의 생물학적 역할. 의학에서 화합물의 사용 붕소는 불순물 미량 원소이며 인체의 질량 분율은 105%입니다. 붕소는 주로 폐(0,34mg), 갑상선(0,30mg), 비장(0,26mg), 간, 뇌(0,22mg), 신장, 심장 근육(0,21mg)에 집중되어 있습니다. 붕소의 생물학적 효과는 아직 충분히 연구되지 않았습니다. 붕소는 치아와 뼈에 존재하는 것으로 알려져 있으며, 붕산과 금속 양이온의 난용성 염 형태로 분명히 존재합니다. 과도한 붕소는 인체에 해롭습니다. 과량의 붕소는 아밀라아제, 프로테이나아제를 억제하고 아드레날린 활성을 감소시킨다는 증거가 있습니다. 인체의 함량(105%)에 따르면 알루미늄은 불순물 미량원소에 속합니다. 알루미늄은 주로 혈청, 폐, 간, 뼈, 신장, 손톱, 머리카락에 집중되어 있으며 인간 두뇌의 신경초 구조에 들어갑니다. 인간의 일일 알루미늄 섭취량은 47mg입니다. 알루미늄은 상피 및 결합 조직의 발달에 영향을 미치고 뼈 조직의 재생은 인의 교환에 영향을 미칩니다. 알루미늄은 효소 과정에 영향을 미칩니다. 체내에 과도한 알루미늄은 헤모글로빈 합성을 억제하는데, 그 이유는 알루미늄의 복합화 능력이 다소 높기 때문에 조혈에 관여하는 효소의 활성 중심을 차단하기 때문입니다. 알루미늄이 아미노전이 반응을 촉매할 수 있다는 증거가 있습니다. 갈륨은 불순물 미량원소(인체의 함량은 10- 6-10- 5%). 살아있는 유기체에서 갈륨의 생물학적 역할은 거의 명확하지 않습니다. 탈륨은 독성이 강한 원소입니다. T1 이온은 Ag+와 마찬가지로 황 함유 리간드와 강한 화합물을 형성하는 경향이 있습니다. 결과적으로 티오 그룹 - SH를 포함하는 효소의 활성을 억제하므로 매우 독성이 있습니다. 극소량의 T1+ 화합물도 섭취하면 탈모를 유발합니다. 반경 K의 근접으로 인해+ 그리고 T1+ 그들은 유사한 특성을 가지고 있으며 효소에서 서로를 대체할 수 있습니다. 이온 T1 및 K는 상승제입니다. 이것은 pyruvate kinase와 diol dehydratase라는 효소가 K 이온뿐만 아니라 T1 이온에 의해서도 활성화된다는 사실을 설명합니다(T1 이온은 효소의 촉매 중심에 있는 K 이온을 대체합니다). 탈륨과 칼륨의 시너지 효과는 K 이온과 마찬가지로 T1 이온이 적혈구에 축적된다는 사실에서도 나타납니다. T1 이온 중독에 대한 해독제로 황 함유 리간드 인 아미노산 시스틴이 사용됩니다. 결론적으로 IIIA군 p-요소의 생물학적 역할이 충분히 연구되지 않았다는 점에 유의해야 합니다. 이제 붕소와 갈륨이 식물에서 폴리페놀과 상호 작용하여 발달 억제제의 독성을 감소시키는 것으로 알려져 있습니다. 상피 및 결합 조직의 구성에서 알루미늄의 의심할 여지 없는 역할, 그리고 또한 활성화제 및 억제제로서 효소 과정에 대한 참여도 확립되었습니다. T1 이온은 많은 황 함유 효소를 억제하는 능력이 있습니다. IIIA족 원소의 생물학적 활성은 주로 산소 함유 리간드 및 불용성 인산염과 복합 화합물을 형성하는 능력과 관련이 있습니다. 48. IVA 그룹의 p-요소의 생물학적 역할. 의학에서 화합물의 사용 인체의 함량(21,15%)에 따르면 탄소는 다량 영양소에 속합니다. 그것은 단백질, 지방, 탄수화물, 비타민, 호르몬 형태의 모든 조직과 세포의 일부입니다. 생물학적 관점에서 탄소는 1순위 유기물질입니다. 인체의 함량(103% ־)에 따르면 규소는 불순물 미량원소에 속한다. 간, 부신, 모발, 수정체에 있는 대부분의 규소. 천연 이산화규소는 물에 잘 녹지 않기 때문에 먼지가 많은 SiO의 형태로 폐를 통해 공기를 통해보다 소화관을 통해 인체에 많이 들어갑니다.2. 실리콘 대사를 위반하면 고혈압, 류머티즘, 궤양, 빈혈이 발생합니다. 의료 실습에서 탄화 규소 (IV) SiC가 사용됩니다 - 충전재 및 플라스틱 보철을 연삭하기위한 카보 런덤. 이산화규소 SiO2 규산염 시멘트의 일부. 석탄, 이산화 규소 및 알루미늄 입자로 구성된 먼지는 체계적으로 폐에 노출되면 진폐증과 같은 질병을 유발합니다. 석탄 먼지의 작용으로 광부의 직업병 인 탄저병입니다. S1O 함유 먼지 흡입2 , 규폐증은 알루미늄 먼지-알루미늄증의 작용으로 발생합니다. 인체의 내용에 따르면 (10- 6-10- 5%) 게르마늄은 미량 원소입니다. 생물학적 역할은 완전히 밝혀지지 않았습니다. 게르마늄 화합물은 골수에서 조혈 과정을 향상시킵니다. 게르마늄 화합물은 독성이 낮은 것으로 알려져 있습니다. 인체의 내용에 따르면 (104 %) 주석은 미량 원소를 나타냅니다. 주석은 주석 층으로 코팅된 주석 캔에 보존된 산성 식품과 함께 인체에 들어갑니다. 산성 환경에서 주석은 용해되어 염의 형태로 혈액에 들어가 독성 효과를 나타냅니다. 그러나 쥐를 대상으로 한 실험에서는 소량의 주석이 쥐의 성장을 자극하는 효과가 있음이 밝혀졌습니다. 이것은 인간에 대한 필요성을 가정하는 이유를 제공합니다. 의심할 여지 없이, 이 미량원소의 생물학적 역할에 대한 해명은 더 많은 연구가 필요합니다. 의료 행위에서 다양한 재료, 특히 주석을 포함하는 충전 재료가 사용됩니다. 따라서 주석은 충전재 제조를 위한 은 아말감(28%)의 일부입니다. 납과 그 화합물, 특히 유기 화합물은 매우 독성이 있습니다. 납 화합물은 단백질 합성, 세포 에너지 균형 및 유전자 장치에 영향을 미칩니다. 많은 요인들이 변성 메커니즘에 찬성합니다. 납은 음식에 존재하면 충치 발병에 영향을 미치는 요소 중 하나라는 것이 입증되었습니다. 음식, 물, 대기와 함께 사람은 매일 최대 100마이크로그램의 납을 흡수합니다. 납은 거의 용해되지 않는 인산염의 형태로 주로 골격(최대 90%)에 침착됩니다. 인체에서 납의 질량 분율은 106%입니다. 매일 0,2-2mg의 납을 섭취하면 인체에 안전한 것으로 간주됩니다. 의료 행위에서 아세트산납(로션)과 산화납(II) PbO(단순 납 패치의 일부)는 외부 수렴성 방부제로 사용됩니다. 49. VA 그룹의 p-요소의 생물학적 역할. 의학에서 화합물의 사용(질소, 인) 인체의 질소 함량(3,1%)은 다량 영양소를 말합니다. 신체의 건조 물질의 질량(물 없음)만 고려하면 세포의 질소 함량은 8-10%입니다. 이 요소는 아미노산, 단백질, 비타민, 호르몬의 필수적인 부분입니다. 질소는 생체 분자에서 수소 및 탄소 원자와 극성 결합을 형성합니다. 많은 생물 무기 복합체(금속 효소)에서 질소 원자는 공여체-수용체 메커니즘에 의해 분자의 무기 부분과 유기 부분을 결합합니다. 질소는 산소 및 탄소와 함께 기본 특성을 지닌 아미노 그룹과 산성 특성을 지닌 카르복실 그룹(-COOH)을 모두 포함하는 아미노산인 필수 화합물을 형성합니다. 아미노 그룹은 또한 핵산 분자에서 매우 중요한 기능을 수행합니다. 헤모글로빈과 같은 포르피린과 같은 질소 함유 바이오리간드의 생리학적 중요성은 엄청납니다. 질소 순환은 생물권에서 발생합니다. 질소 순환은 농업에 필수적입니다. 질소의 생물학적으로 중요한 특성 중 하나를 더 주목해야 합니다. 물에 대한 용해도는 산소의 용해도와 거의 같습니다. 혈액에 과도한 질소가 존재하면 감압병이 발생할 수 있습니다. 다이버의 급격한 상승과 함께 급격한 압력 강하가 발생하고 그에 따라 혈액 내 질소의 용해도가 감소하고(헨리의 법칙), 혈액을 떠나는 원소 질소 기포가 작은 혈관을 막아 마비와 사망으로 이어질 수 있습니다. 인체 내 함량(0,95%)에 따르면 인은 다량영양소에 속한다. 인은 유기원소이며 신진대사에 매우 중요한 역할을 합니다. 인산염 형태의 인은 세포 내 ATP의 필수 구성 요소입니다. 그것은 단백질(0,5-0,6%), 핵산, 뉴클레오티드 및 기타 생물학적 활성 화합물의 일부입니다. 인은 동물과 인간의 골격(칼슘 오르토포스페이트, 하이드록실아파타이트), 치아(하이드록시아파타이트, 플루오라파타이트)의 기초입니다. 많은 생합성 반응은 고에너지 수용체에서 저에너지 수용체로 인산염 그룹의 이동으로 인해 수행됩니다. 인산염 완충 시스템은 혈액의 주요 완충 시스템 중 하나입니다. 살아있는 유기체는 인 없이는 할 수 없습니다. 인의 중요성은 당과 지방산이 사전 인산화 없이는 세포에서 에너지원으로 사용할 수 없다는 사실에 있습니다. 체내 인의 교환은 칼슘의 교환과 밀접한 관련이 있습니다. 이것은 혈액 내 칼슘 함량이 증가함에 따라 무기 인의 양이 감소하여 확인됩니다(길항작용). 인에 대한 인간의 일일 필요량은 1,3g이며, 인은 식품에 널리 퍼져 있어 인산염 결핍(인 결핍)의 사례는 거의 알려져 있지 않습니다. 그러나 식품에 포함된 모든 인을 흡수할 수 있는 것은 아닙니다. 그 흡수는 pH, 식품 내 칼슘과 인의 비율, 식품 내 지방산의 존재, 무엇보다도 비타민 함량 등 여러 요인에 따라 달라지기 때문입니다. 디. 많은 인 화합물이 의약품으로 사용됩니다. C-P 결합을 포함하는 유기인 화합물은 강한 신경독이며 화학무기의 일부라는 점에 유의해야 합니다. 50. VA 그룹의 p-요소(비소, 안티몬, 비스무트)의 생물학적 역할. 의학에서의 사용 인체의 함량에 따르면 비소는 미량 원소에 속합니다. 간, 신장, 비장, 폐, 뼈, 모발에 집중한다. 대부분의 비소는 뇌 조직과 근육에서 발견됩니다. 비소는 뼈와 머리카락에 축적되어 몇 년 동안 완전히 제거되지 않습니다. 이 기능은 비소 화합물 중독 여부에 대한 질문을 명확히 하기 위해 법의학 조사에 사용됩니다. 생물학적 물질의 비소 측정은 습지 반응에 따라 간단한 장치에서 수행됩니다. 아연과 염산이 생물학적 개체에 추가됩니다. 반응 중에 방출된 수소는 모든 비소 화합물을 아르신으로 환원시킵니다. 유리된 수소에 아르신 혼합물이 포함되어 있으면 기체 혼합물이 가열될 때 AsH가 분해됩니다.3 : 2회3 = 2As° + 3H2. 그리고 가스 방출을 위한 튜브의 벽에는 "비소 거울"이라는 검은색의 반짝이는 비소 코팅이 형성됩니다. Marsh 반응은 매우 민감하며 7-10을 감지할 수 있습니다.7 g 비소. 비교적 많은 양의 비소 화합물은 매우 독성이 있습니다. 이미 언급했듯이 비소 화합물의 독성 효과는 효소 및 기타 생물학적 활성 물질의 설프히드릴 그룹을 차단하기 때문입니다. 인체의 함량(10%)에 따르면 안티몬과 비스무트는 미량 원소입니다. V. V. Kovalsky의 분류에 따르면 안티몬과 비스무트는 살아있는 유기체에서 지속적으로 발견되는 미량 원소 그룹에 속하지만 생리적 및 생화학 적 역할은 실제로 명확하지 않습니다. 안티몬의 생리학적 역할은 분명히 비소의 역할과 유사합니다. 비소 As 및 안티몬 Sb의 이온, 그리고 덜하지만 비스무트 Bi는 상승제입니다. 따라서 유기체에 과량의 비소가있는 생지 화학적 지역에서는 비소뿐만 아니라 안티몬의 함량도 증가하는 것으로 알려져 있습니다. 동시에 두 요소 모두 주민의 갑상선에 축적되어 기능을 억제하고 풍토성 갑상선종을 유발합니다. 비소와 안티몬의 상승 작용은 황 함유 리간드와 화합물을 형성하는 능력과 관련이 있습니다. 비스무트는 아미노기를 포함하는 리간드와 결합하는 경향이 있습니다. 따라서 용해성 비스무트 화합물이 체내로 침투하면 아미노 및 카르복시폴리펩티다아제 효소가 억제됩니다. 스티빈 SbH3와 같은 수용성 안티몬 화합물의 섭취는 비소 화합물과 유사한 독성 효과를 나타냅니다. 비스무트 화합물은 또한 주입 시 독성이 있습니다. 예를 들어 개의 경우 치사량은 6mg/kg 체중입니다. 그러나 대부분의 안티몬과 비스무트 화합물이 소화관에 들어가면 실질적으로 독성 효과가 없습니다. 이러한 화합물의 약한 독성은 소화관의 Sb(III), Bi(III) 염이 가수분해되어 위장관 벽에 흡수되지 않는 난용성 생성물이 형성된다는 사실 때문입니다. 이것은 염기성 질산 비스무트와 같은 안티몬 및 비스무트 약물 사용의 기초입니다. 51. VIA 그룹의 p-요소의 생물학적 역할. 의학에서 화합물의 사용 인체의 함량(62%)에 따르면 산소는 다량 영양소에 속합니다. 그것은 없어서는 안될 존재이며 생명체의 기초를 형성하는 가장 중요한 요소 중 하나, 즉 유기체입니다. 산소는 가장 단순한 것부터 생체 고분자에 이르기까지 수많은 분자의 일부입니다. 영양소(탄수화물, 단백질, 지방)를 산소로 산화시키는 것은 생명체의 기관과 조직의 기능에 필요한 에너지원으로 작용하기 때문에 생명 과정에서 산소의 역할은 큽니다. 신체의 대부분의 산화 환원 반응은 산소와 그 활성 형태의 참여로 진행됩니다. 신체의 식세포(보호) 기능은 또한 산소의 존재와 관련이 있으며, 신체의 산소 함량이 감소하면 보호 특성이 낮아집니다. 식세포(이물질을 포획하고 소화할 수 있는 세포)에서 산소 O02는 과산화물로 환원됩니다. 의료 실습에서 산소는 산소 결핍 (저산소증), 호흡기 질환, 심혈관 질환, 일산화탄소 (II) CO 중독, 시안화 수소산 HCN 및 호흡기 기능 장애가있는 질병을 동반하는 고통스러운 상태에서 흡입에 사용됩니다. . 임상 실습에서 널리 사용되는 고압산소화는 고압에서 산소를 사용하는 것입니다. 산소의 동소체 변형 - 매우 강력한 산화제인 오존 O3는 건물의 소독, 공기 소독 및 음용수의 정화에 사용됩니다. 인체 내 함량(0,16%)에 따르면 황은 다량영양소에 속한다. 산소와 마찬가지로 필수적입니다. 유황에 대한 성인의 일일 요구량은 약 4-5g이며 유황은 단백질, 아미노산 (시스틴, 시스테인, 메티오닌 등), 호르몬 (인슐린), 비타민 (비타민 B1)과 같은 많은 생체 분자의 일부입니다. 머리카락, 뼈, 신경 조직의 카로틴에는 많은 유황이 있습니다. 살아있는 유기체에서는 아미노산의 일부인 황이 산화됩니다. 이 공정의 최종 생성물은 주로 황산염입니다. 또한, 티오황산염, 시멘트 황 및 폴리티온산이 형성됩니다. 체내 내용에 따라(10- 5-10- 7%) 셀레늄은 미량 원소입니다. 일부 연구자들은 이것이 중요한 요소라고 생각합니다. 셀레늄은 음식에서 나옵니다 - 연간 55-110mg. 셀레늄은 주로 간과 신장에 집중되어 있습니다. 혈액 내 셀레늄 농도는 0,001-0,004mmol / l입니다. 살아있는 유기체에서 셀레늄과 황의 연결은 의심의 여지가 없습니다. 고용량에서 셀레늄은 황 함유 아미노산을 기반으로 하는 손톱과 머리카락에 주로 축적됩니다. 셀레늄이 수은 Hg 및 카드뮴 카드뮴 중독으로부터 신체를 보호하는 능력도 알려져 있습니다. 셀레늄은 독성 효과의 영향을 받지 않는 다른 활성 중심에 이러한 독성 금속의 결합을 촉진합니다. 흥미로운 사실은 식단에서 높은 셀레늄 함량과 낮은 암 사망률 사이의 관계입니다. 셀레늄은 고용량에서 유독합니다. 동물에서 셀레늄 화합물이 분해되면 마늘 냄새가 나는 고독성 디메틸 셀레늄이 방출됩니다. 52. 그룹 VIIA의 p-요소의 생물학적 역할. 의약에서의 화합물의 사용(불소 및 염소) 인체의 함량에 따라 염소(0,15%)는 거시원소에 속하며 이 그룹의 나머지 요소는 미량원소(함량 - 105 %). 다양한 화합물 형태의 할로겐은 인간과 동물 조직의 일부입니다. 염소와 요오드는 대체할 수 없는 요소이며 나머지는 조직의 영구적인 구성 요소입니다. 인체의 불소 질량은 약 7mg(~105 %). 불소 화합물은 뼈 조직, 손톱, 치아에 집중되어 있습니다. 치아의 구성에는 약 0,01%의 불소가 포함되어 있으며 대부분은 에나멜에 있으며, 이는 그 안에 난용성 플루오르인회석의 존재와 관련이 있습니다. 몸에 불소가 부족하면 치아 우식증이 발생합니다. 불소는 충치로부터 치아를 보호하기 때문에 불소의 생물학적 작용에 대한 관심은 주로 치과 질환의 문제와 관련이 있습니다. 치아 조직(상아질)의 미네랄 기반은 수산화인회석, 염소인회석 및 플루오르인회석입니다. 종종 법랑질 층으로 덮인 치아의 외부 표면이 파괴되는 것이 아니라 법랑질이 손상되면 상아질의 내부 부분이 노출됩니다. 법랑질이 약간 손상되는 동안 불화 나트륨의 도입은 플루오르 인회석의 형성을 촉진하여 시작된 손상의 재광화를 촉진한다는 제안이 있습니다. 불화나트륨 NaF는 의료 행위에서 국소 외용제로 사용됩니다. NaF의 사용은 형석 인회석의 형성을 기반으로 합니다. 동시에 구강 환경의 알칼리화도 발생하여 박테리아가 생성하는 산의 중화에 기여합니다. 부족할 뿐만 아니라 과량의 불소도 해롭습니다. 식수의 불소 함량이 최대 허용치(1,2mg/l)를 초과하면 치아 법랑질이 부서지기 쉽고 쉽게 파괴되며 만성 불소 중독의 다른 증상이 나타납니다. . 이런 경우에 발생하는 질환을 불소증(fluorosis)이라고 합니다. 인체에는 약 100g(2790mmol)의 염소가 포함되어 있습니다. 염화물은 중요한 생물학적 역할을 합니다. 그들은 일부 효소를 활성화하고, 위액의 protolytic 효소 작용에 유리한 환경을 조성하고, 세포막을 통해 이온 플럭스를 제공하고, 삼투 균형을 유지하는 데 참여합니다. Chloridion은 세포막을 통과하는 최적의 반경을 가지고 있습니다. 이것은 특정 삼투압 생성 및 물-소금 대사 조절에 Na 및 K 이온과의 공동 참여를 설명합니다. 염화나트륨의 일일 요구량은 5-10g이며 이미 논의한 바와 같이 NaCl은 위장에서 염산 생성에 필요합니다. 소화 과정에서 염산의 중요한 역할 외에도 다양한 병원성 박테리아(콜레라, 장티푸스)를 파괴합니다. 박테리아가 다량의 물로 위장에 들어가면 HCl의 희석으로 인해 항균 효과가없고 박테리아가 생존합니다. 이것은 신체의 질병으로 이어집니다. 따라서 전염병 동안 원수는 특히 위험합니다. 위장에 염산이 충분하지 않으면 pH가 상승하고 정상적인 소화가 방해되어 인체 건강에 심각한 영향을 미칩니다. 위액의 산도가 감소하여 묽은 염산 용액이 의료 행위에 사용됩니다. 위 염증 (위염), 소화성 궤양, 위액 분비가 증가하고 산도가 증가합니다. 53. 그룹 VIIA의 p-요소의 생물학적 역할. 의약에서의 화합물의 사용(브롬, 요오드) 인체의 브롬 질량은 약 7mg입니다. 그것은 주로 내분비선, 주로 뇌하수체에 국한됩니다. 신체의 정상적인 기능에서 브롬 화합물의 생물학적 역할은 아직 충분히 해명되지 않았습니다. 브롬 화합물은 갑상선 기능을 억제하고 부신 피질의 활동을 증가시킵니다. 브롬이온이 체내로 유입되면 중추신경계가 가장 민감합니다. 브로미디온은 뇌의 여러 부분에 고르게 축적되어 흥분성을 높여 침착하게 작용합니다. 그들은 흥분과 억제 과정 사이의 교란된 균형의 회복에 기여합니다. 브로미디온은 위장관에서 쉽게 흡수됩니다. 브로미디온의 독성은 낮습니다. 몸에서 천천히 배설되기 때문에(30-60일 이내) 축적(누적)되어 브롬증이라고 하는 만성 중독이 발생할 수 있습니다. 만성 브롬 중독의 징후가 나타나면 브롬화물 제제를 즉시 중단해야 합니다. 또한 다량의 염화나트륨을 투여하여(25일 최대 0,05g) 브롬화물의 방출 속도를 높이고(르샤틀리에의 원리) 충분한 양의 음료를 처방합니다. 개인의 민감도가 다르기 때문에 브롬 제제의 복용량은 2,0~XNUMXg입니다. 요오드는 필수 생체 요소 중 하나이며 그 화합물은 대사 과정에서 중요한 역할을 합니다. 요오드는 특정 단백질, 지방, 호르몬의 합성에 영향을 미칩니다. 인체에는 약 25mg의 요오드가 포함되어 있습니다. 신체의 요오드 총량 중 절반 이상이 갑상선에 있습니다. 이 분비샘에 포함된 거의 모든 요오드는 결합 상태(호르몬 형태)이며 약 1%만이 요오드디온 형태입니다. 갑상선은 혈장 내용물에 비해 I-25배를 농축할 수 있습니다. 갑상선은 티록신과 트리요오드티로닌이라는 호르몬을 분비합니다. 갑상선 기능 저하증(갑상선 기능 저하증)은 요오드 이온 축적 능력의 감소와 식이 요법의 요오드 결핍(풍토성 갑상선종)과 관련이 있을 수 있습니다. 풍토성 갑상선종으로 요오드 제제가 처방됩니다: (요오드화 칼륨 KI 또는 요오드화 나트륨 NaI) 요오드에 대한 인간의 일일 필요량에 해당하는 용량(요오드화 칼륨 0,001g). 요오드 결핍이 있는 지역에서는 식염에 NaI 또는 K를 첨가하여 풍토성 갑상선종을 예방합니다! (1kg 당 2,5-100g). 갑상선 활동이 증가하면(갑상선 기능 항진증) 갑상선 호르몬의 과도한 합성으로 인해 대사 과정의 비율이 비정상적으로 증가합니다. 갑상선 기능 항진증 치료를위한 이러한 약물의 효과가 없기 때문에 방사성 요오드 131 I 제제가 사용되며 방사선은 갑상선의 여포를 파괴하여 호르몬의 과잉 합성을 감소시킵니다. VIIA 족의 모든 요소는 생리적으로 활성이며 염소와 요오드는 유기체의 중요한 활동에 필수적입니다. 불소는 살아있는 유기체의 정상적인 기능에 필요한 요소로 간주됩니다. 신체에서 할로겐은 상호 교환이 가능하며 시너지와 길항의 경우가 모두 관찰됩니다. 54. 에어로졸 에어로졸은 기체 분산 매질이 있는 분산 시스템입니다. 분산상의 응집 상태에 따라 안개가 구별됩니다-액체 분산상의 에어로졸; 연기, 먼지 - 고체 분산상의 에어로졸; 스모그 - 혼합 분산상을 갖는 에어로졸. 분산 시스템의 분류에 따라 에어로졸의 분산상의 입자 크기는 10에서 XNUMX7 10에9 엠 다른 분산 시스템과 마찬가지로 에어로졸은 응축과 분산의 두 가지 방법으로 얻습니다. 응축 방법 분산상은 분자가 콜로이드 크기의 입자로 응축되는 물리적 과정에 의해 증기상으로부터 얻어진다. 분산 방법 콜로이드 크기의 입자는 더 큰 골재를 분쇄하여 얻습니다. 에어로졸은 빛을 산란시키는 능력이 있습니다. 에어로졸의 분산상 입자는 이중 전기층을 갖지 않지만 분산상 입자는 종종 전하를 띤다. 전하는 마찰이나 기체 이온의 흡착으로 인해 발생합니다. 매우 자주 에어로졸 입자(작거나 큰)는 반대 부호의 전하를 띤다는 점에 유의해야 합니다. 높이를 따라 대량의 에어로졸에서 크기별로 입자를 분리하면 높은 강도의 전기장이 나타날 수 있습니다. 따라서 구름에서 번개가 발생합니다. 에어로졸은 위상 경계에 이중 전기층이 없기 때문에 동역학적으로 그리고 종합적으로 불안정한 시스템입니다. 따라서 에어로졸은 리오졸보다 더 빠른 속도로 응고됩니다. 의학에서 에어로졸은 손상된 피부, 소독을 보호하기 위해 흡입 요법에 사용됩니다. 때때로 에어로졸의 형성은 매우 바람직하지 않습니다. 인체 건강에 유해한 에어로졸은 다양한 광물(광석, 석탄, 석면 등)의 추출 및 가공 중에 주조, 세라믹 산업에서 형성됩니다. 석탄 입자를 포함하는 에어로졸은 탄저병, 산화규소(IV) - 규폐증, 석면 - 석면폐증과 같은 폐 질환을 유발합니다. 알레르기 질환은 식물 꽃가루에 의해 형성된 에어로졸, 면화, 아마, 대마 등을 가공하는 동안 생성된 먼지에 의해 발생합니다. 박테리아, 곰팡이 및 바이러스의 현탁액(미생물 또는 박테리아 에어로졸)은 전염병을 전염시키는 방법 중 하나입니다: 폐결핵 , 인플루엔자, 급성 호흡기 질환. 인체에 유해한 영향은 그을음, 타르, 회분 및 발암성 탄화수소로 구성된 분산 단계인 연료 연소 중에 형성된 에어로졸에 의해 생성됩니다. 스모그는 특히 건강에 해롭습니다. 따라서 먼지와 대기 오염과의 싸움이 점점 더 중요해지고 있습니다. 에어로졸의 공기 정화는 필터, 사이클론(원심 집진기) 및 고전압 전기장을 사용하여 분산상의 입자를 포획하는 비폐기물 기술을 도입하여 이루어집니다. 55. 에멀젼 에멀젼은 분산상과 분산 매체가 섞이지 않는 액체인 미세 이질적인 시스템입니다. 분산상의 입자 크기(액적)는 104~106m입니다. 분산상의 농도에 따라 에멀젼은 희석, 농축 및 고농축으로 구분됩니다. 분산상의 특성과 분산 매질에 따라 다음이 있습니다. 1) 극성 액체(DS)에서 비극성 액체(DF)의 에멀젼 - 첫 번째 종류의 에멀젼 또는 "오일/물" 유형(O/W)의 에멀젼이라고 하는 직접 에멀젼; 2) 비극성 액체 (DF)의 에멀젼 - 역 에멀젼, 두 번째 종류의 에멀젼 또는 "물 / 오일"유형의 에멀젼 (W / O)이라고합니다. 여기서 DF와 DS는 각각 분산상과 분산매이며, "물"은 임의의 극성 액체, "기름"은 비극성 액체이다. 에멀젼 유형은 다음과 같이 설정할 수 있습니다. 1) 전기 전도도 측정; 2) 과량의 극성 또는 비극성 액체와 혼합; 3) 수용성 또는 유용성 염료로 염색; 4) 소수성 또는 친수성 표면에 에멀젼 방울을 적시고 퍼짐. 에멀젼은 다른 분산 시스템과 마찬가지로 축합 및 분산 방법에 의해 얻어진다. 조대 분산액으로서의 에멀젼은 동역학적으로 그리고 총체적으로 불안정한 시스템입니다. 분산상의 액적이 충돌하면 합쳐집니다(유착). 유착의 결과로 에멀젼은 두 개의 연속 액체 상으로 분리됩니다. 유화제는 에멀젼의 안정성을 높이기 위해 사용됩니다. 이들은 상경계에서의 흡착 결과 계면 장력 값을 감소시키고 기계적으로 강한 흡착막을 형성하는 계면활성제입니다. 유화제가 이온성 계면활성제인 경우 분산상의 액적에 동일한 부호의 전하를 부여하고 액적은 서로 반발합니다. 형성되는 에멀젼의 유형은 유화제의 특성에 따라 다릅니다. 분산 매질은 항상 유화제를 가장 잘 녹이거나 적시는 액체입니다. 고급 지방산의 염, 고급 지방산 및 다가 알코올의 에스테르, 장쇄 아민이 유화제로 사용됩니다. 에멀젼은 자연에서 널리 발견됩니다. 에멀젼은 우유, 크림, 사워 크림, 버터, 달걀 노른자, 유백색 식물 주스, 원유입니다. 의약 물질을 함유한 유제는 의약에 널리 사용됩니다. 첫 번째 유형(O/W)은 내복용이고 두 번째 유형(W/M)은 외용입니다. 식물성 및 동물성 지방은 유화된 형태(우유)로 체내에 더 잘 흡수되는 것으로 알려져 있습니다. 이 경우 콜산 및 데옥시콜산의 유도체가 유화제로 작용합니다. 때로는 결과 유제를 깨뜨릴 필요가 있습니다. 유화액이 깨지는 것을 해유화라고 합니다. 해유화는 온도 상승 및 하강, 전기장 노출, 원심분리, 전해질 및 특수 물질(해유화제) 첨가를 통해 수행됩니다. 항유화제는 유화제보다 표면활성이 큰 계면활성제이지만 기계적으로 강한 흡착층을 형성하는 능력은 없다. 56. 콜로이드성 계면활성제 콜로이드 계면 활성제는 조건에 따라 동일한 용매로 진정한 콜로이드 용액을 형성하는 물질입니다. 이미 언급한 바와 같이 계면활성제 분자는 양친매성입니다. 그들은 비극성 및 극성 그룹으로 구성됩니다. 비극성 라디칼, 예를 들어 탄화수소 사슬은 극성 용매인 물에 대해 친화력이 없으며 극성 그룹에 대해서는 상당히 높습니다. 비극성 그룹 사이에는 소수성(반데르발스) 상호작용이 있습니다. 체인 길이 약 1022 탄화수소 라디칼의 소수성 상호 작용과 물과 극성 그룹의 강한 상호 작용으로 인해 탄소 원자, 계면 활성제 분자가 결합되어 미셀이 형성됩니다. 용액에서 미셀이 형성되는 콜로이드성 계면활성제의 최소 농도를 임계 미셀 농도(CMC)라고 합니다. 생성된 미셀의 모양은 용액의 농도에 따라 다릅니다. 낮은 농도의 콜로이드성 계면활성제에서는 구형 미셀이 형성됩니다. 콜로이드 계면 활성제 용액의 농도가 증가하면 먼저 그 수가 증가한 다음 모양이 변경됩니다. 더 높은 농도에서는 구형 미셀 대신 원통형 및 라멜라 미셀이 형성됩니다. CMC 값은 콜로이드 계면활성제의 성질, 온도, 이물질, 특히 전해질의 불순물 존재와 같은 다양한 요인에 따라 달라집니다. CMC는 동역학 활성 입자의 수와 크기, 특히 삼투압, 표면 장력, 전기 전도도 및 광학적 특성의 변화에 따라 달라지는 용액의 특성에 의해 결정될 수 있습니다. 동역학적 활성 입자(이온, 분자, 미셀)의 크기와 그 수가 "진용액 - 콜로이드 용액"으로 전환되는 동안 변하기 때문에 "특성 - 농도" 그래프에 CMC에 해당하는 중단점이 나타납니다. 콜로이드 계면 활성제 용액의 가장 중요한 특성 중 하나는 국가 경제 및 의료의 다양한 분야에서 널리 사용되기 때문에 가용화입니다. 가용화 메커니즘은 미셀의 소수성 코어에서 비극성 물질의 용해로 구성됩니다. 가용화 현상은 국가 경제의 다양한 부문, 즉 식품 산업, 제약 산업(액체 형태의 의약 물질을 얻기 위해)에서 널리 사용됩니다. "물 - 인지질" 시스템에서 진탕 및 교반은 구형 미셀 - 리포솜을 형성합니다. 인지질 분자는 리포솜에서 극성기가 물을 향하고 비극성기가 서로 마주하는 이중막을 형성합니다. 리포좀은 생체막의 모델로 간주될 수 있습니다. 그들은 막의 투과성과 다양한 화합물에 대한 다양한 요인의 영향을 연구하는 데 사용할 수 있습니다. 리포솜은 특정 기관이나 영향을 받는 부위에 약물을 표적으로 전달하는 데 널리 사용됩니다. 리포솜은 약물을 세포로 운반할 수 있습니다. 리포솜 막은 항체와 항원 간의 상호 작용을 연구하기 위해 면역학 연구에 사용됩니다. 저자: Drozdova M.V., Drozdov
정원의 꽃을 솎아내는 기계
02.05.2024 고급 적외선 현미경
02.05.2024 곤충용 에어트랩
01.05.2024
▪ Frigyes Karinthi의 기사. 유명한 격언 ▪ 기사 매머드 뼈가 기독교 성인의 유물로 숭배되었던 곳은 어디입니까? 자세한 답변 ▪ 기사 바이오가스 플랜트의 이점. 무선 전자 및 전기 공학 백과사전
홈페이지 | 도서관 | 조항 | 사이트 맵 | 사이트 리뷰 www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 다른 기사 보기 섹션
다른 기사 보기 섹션 