
|
|
강의 요약, 유아용 침대
병원 치료. 강의 노트: 간략하게, 가장 중요한
차례
강의 1. 심혈관 질환. 류머티즘 류마티스 (Sokolsky-Buyo 병)은 급성 감염으로 인해 소인이있는 사람 (일반적으로 젊은이)에서 발생하는 심혈관 계통의 과정이 우세한 결합 조직의 전신 염증성 질환입니다. A군 β-용혈성 연쇄상구균. 이 질병의 정의는 1989년 V. A. Nasonov에 의해 주어졌습니다. 그것은 질병의 모든 특징을 반영합니다. 1) 심혈관계의 주요 손상; 2) 병리학 적 유전의 역할; 3) 연쇄상 구균 감염의 중요성. 질병의 본질은 심장의 모든 막의 패배에 있지만 판막 장치의 변형 - 심장 질환 및 후속 심부전의 발생으로 주로 심근 및 심내막이 패배합니다. 류머티즘에서 다른 기관 및 시스템의 패배는 이차적으로 중요하며 그 심각성과 후속 예후를 결정하지 않습니다. 병인학. 그룹 A 베타 용혈성 연쇄구균은 상부 호흡기에 손상을 줍니다. 그렇기 때문에 류머티즘의 발병은 일반적으로 인후통, 만성 편도선염의 악화, 연쇄상 구균 항원 및 항 연쇄상 구균 항체 (ASL-O, ASG, ASA, 항 디옥시리보 뉴 클레아 제 B (항)의 양이 증가합니다)가 선행됩니다. -DNase B))는 환자의 혈액에서 검출됩니다. 이전의 연쇄상 구균 감염과의 이러한 연결은 특히 다발성 관절염을 동반한 류머티즘의 급성 과정에서 두드러집니다. 류머티즘의 발달에는 연령과 사회적 요인(열악한 생활 조건, 영양실조)이 작용하고 유전적 소인도 중요합니다(류머티즘은 다유전성 질환이며 "류마티스" 가족의 존재가 잘 알려져 있습니다). 연쇄상 구균 항원에 대한 과면역 반응, 자가면역 및 면역복합 과정에 대한 환자의 경향. 병인. 류머티즘의 경우 수많은 연쇄구균 항원에 대해 복잡하고 다양한 면역 반응(즉각적 및 지연성 과민 반응)이 발생합니다. 감염이 몸에 들어가면 항 연쇄상 구균 항체가 생성되고 면역 복합체 (연쇄 구균 항원 + 이에 대한 항체 + 보체)가 형성되어 혈액을 순환하고 미세 순환계에 정착합니다. 연쇄상 구균 독소와 효소는 또한 심근과 결합 조직에 해로운 영향을 미칩니다. 면역 체계의 유전적으로 결정된 결함으로 인해 연쇄상 구균 항원과 면역 복합체가 환자의 몸에서 완전하고 신속하게 제거되지 않습니다. 그러한 환자의 조직은 이러한 면역 복합체를 고정시키는 경향이 증가합니다. 교차 반응 항체는 연쇄상 구균 항원에 형성되어 심장을 포함한 조직, 신체 항원과 반응할 수 있는 역할을 합니다. 이에 대한 반응으로 염증은 면역 기반(즉각적 과민증의 유형에 따라 다름)으로 진행되는 반면, 염증 과정을 구현하는 요인은 면역 복합체를 포식하고 동시에 파괴되는 호중구의 리소좀 효소입니다. 이 염증 과정은 주로 심혈관계의 결합 조직에 국한되며, 결합 조직과 심근의 항원 특성을 변화시킵니다. 그 결과 지연형 과민증의 종류에 따라 자가면역 과정이 진행되고, 환자의 혈액에서는 심장 조직과 반응하는 림프구가 발견된다. 이 세포는 장기 병변(주로 심장)의 기원에서 매우 중요합니다. 류머티즘이 있는 결합 조직에서는 점액 종창 - 섬유소 변화 - 섬유소 괴사와 같은 위상 변화가 발생합니다. 면역 장애의 형태 학적 표현은 세포 반응입니다 - 림프구 및 형질 세포에 의한 침윤, 류마티스 형성 또는 Ashoff-Talalayevsky, 육아종. 병리학 적 과정은 경화증으로 끝납니다. 류마티스성 심장 질환에서 심장 손상의 또 다른 형태학적 기질은 관절 및 장액막에서와 유사한 비특이적 염증 반응입니다: 근육간 결합 조직의 팽창, 섬유소 발한, 호중구 및 림프구에 의한 침윤. 질병은 병리학 적 과정의자가 면역 특성과 관련된 감염 또는 비특이적 요인 (저체온증, 육체적 스트레스, 스트레스 등)의 영향으로 악화되는 파도로 흐릅니다. 심장이 영향을 받으면 염증 과정이 심장의 모든 막으로 퍼질 수 있거나(pancarditis) 각 막으로 분리되어 퍼질 수 있습니다. 류머티즘의 형태적 변화는 주로 심근에서 발견되므로 임상 양상을 결정하는 것은 초기 단계의 심근염입니다. 류머티즘 발병 후 6-8주에 심내막의 염증 변화(판막염, 심내막염), 힘줄 필라멘트 및 섬유 고리의 손상이 임상적으로 감지됩니다. 승모판이 가장 흔하게 영향을 받고 대동맥판과 삼첨판막이 그 뒤를 잇습니다. 류머티즘의 폐동맥 판막은 거의 영향을 받지 않습니다. 류머티즘의 분류. 현재 1990년 All-Union Scientific Society of Rheumatology에서 승인한 류마티스의 분류 및 명명법이 채택되어 과정의 단계, 장기 및 시스템 손상의 임상적 및 해부학적 특성, 과정의 성격을 반영합니다. 및 심혈관계의 기능적 상태(표 1 참조). 임상 사진. 질병의 모든 증상은 심장 및 심장 외로 나눌 수 있습니다. 질병의 임상상은 이러한 입장에서 설명될 수 있습니다. 1단계: 질병과 전이된 감염의 연관성이 드러납니다. 전형적인 경우 인후통이나 급성 호흡기 질환 후 2-38주 후에 체온이 올라가 때로는 40-1°C까지 오르고 낮에는 2-XNUMX°C 이내의 변동과 강한 땀(보통 오한이 없음)이 있습니다. 류머티즘의 반복적인 공격으로 질병의 재발은 종종 비특이적 요인(예: 저체온증, 신체적 과부하, 수술)의 영향으로 발생합니다. 표 1 류머티즘의 분류
류머티즘의 가장 흔한 징후는 심장 손상입니다 - 류마티스 심장 질환: 심근과 심내막 동시 손상. 성인의 경우 류마티스성 심장병은 심각하지 않습니다. 환자는 심장 부위의 경미한 통증이나 불편함, 운동 중 약간의 숨가쁨, 중단 또는 심계항진을 호소하는 경우가 훨씬 적습니다. 이러한 증상은 류마티스성 심장 질환에만 국한되지 않으며 다른 심장 질환에서도 나타날 수 있습니다. 이러한 불만의 성격은 진단 검색의 후속 단계에서 지정됩니다. 일반적으로 젊은 환자의 류마티스 성 심장 질환은 심각합니다. 질병의 초기부터 운동 및 휴식 중 심한 호흡 곤란, 지속적인 심장 통증 및 심계항진이 나타납니다. 오른쪽 hypochondrium에 부종과 무거움의 형태로 큰 원에 순환 부전의 증상이있을 수 있습니다 (간 증가로 인해). 이러한 모든 증상은 중증 미만성 심근염을 나타냅니다. 심낭염과 류머티즘의 심장외 증상은 드뭅니다. 건성 심낭염이 발생하면 환자는 심장 부위의 지속적인 통증에만 주목합니다. 심장낭에 장액-섬유소 삼출물이 축적되는 것을 특징으로 하는 삼출성 심낭염의 경우, 축적된 삼출물에 의해 염증이 있는 심낭층이 분리되면서 통증이 사라집니다. 호흡 곤란이 나타나며 환자의 수평 위치에 따라 증가합니다. 우심장으로의 혈류의 어려움으로 인해 울혈이 큰 원으로 나타납니다 (부종, 간의 증가로 인한 오른쪽 hypochondrium의 무거움). 류머티즘의 가장 큰 특징은 류마티스성 다발성 관절염의 형태로 근골격계의 패배입니다. 환자는 큰 관절 (무릎, 팔꿈치, 어깨, 발목, 손목)의 통증이 급격히 증가하고 활동적인 움직임이 불가능하며 관절의 부피가 증가합니다. 아세틸 살리실산 및 기타 비 스테로이드 성 항염증제를 사용하면 며칠, 종종 모든 관절 증상이 몇 시간 동안 완화되는 빠른 효과가 있습니다. 신장의 류마티스 병변도 극히 드물며 소변 연구에서만 발견됩니다. 류머티즘의 신경계 병변은 드물며 주로 소아에서 발생합니다. 증상은 뇌염, 수막뇌염, 다른 병인의 뇌혈관염과 유사합니다. "작은 무도증"만이 어린이 (더 자주 소녀)에서 발생하며 몸통, 팔다리 및 모방 근육의 정서적 불안정과 폭력적인 과운동의 조합으로 나타납니다. 복부 증후군(복막염)은 급성 원발성 류머티즘이 있는 소아 및 청소년에게 거의 독점적으로 발생합니다. 갑작스런 발병, 열, 연하 곤란(분산성 또는 국부적 경련성 통증, 메스꺼움, 구토, 정체 또는 빈번한 대변 발생)의 징후가 특징입니다. 진단 검색의 II 단계에서 심장 손상 징후의 감지는 거의 중요하지 않습니다. 원발성 류마티스 심장병에서 심장은 일반적으로 비대하지 않습니다. 청진에서는 희미한 I 톤이 나타나며 때로는 정점에서 부드러운 수축기 잡음인 III 톤이 나타납니다. 이 증상은 심근의 변화로 인한 것입니다. 그러나 소음의 강도, 지속 시간 및 지속성의 증가는 승모판 부전의 형성을 나타낼 수 있습니다. 위의 청진상을 유지하면서 발병 6개월 후 결손의 형성을 자신있게 판단할 수 있다. 대동맥판막 손상의 경우 Botkin point에서 proto-diastolic murmur를 들을 수 있으며 II tone의 음파를 보존할 수 있습니다. 몇 년 후, 심각한 대동맥 판막 기능 부전이 형성된 후 오른쪽 II 늑간 공간에서 II 음색의 약화(또는 부재)가 이 청진 징후에 합류합니다. 다발성 관절염 환자의 경우 활막과 관절 주위 조직의 염증, 관절 촉진 시 통증으로 인해 관절 기형이 나타납니다. 영향을받는 관절 부위에서 뼈 돌출부 위의 팔뚝과 정강이에 위치한 류마티스 결절이 나타날 수 있습니다. 이들은 치료의 영향으로 사라지는 작고 조밀하며 고통없는 형성입니다. 고리 모양 홍반(류머티즘에 대해 거의 병리학적인 징후)은 가렵지 않은 분홍색 고리 모양의 요소로 팔과 다리, 복부, 목 및 몸통의 내면 피부에 위치합니다. 이 증상은 매우 드뭅니다(환자의 1-2%). 류마티스성 폐렴과 흉막염은 진부한 병인의 유사한 질병과 동일한 물리적 징후를 보입니다. 일반적으로 비심장성 병변은 현재 급성 류머티즘 경과를 보이는 젊은이들(높은 활동성 - III 정도)에서 극히 드물게 관찰됩니다. 그들은 뚜렷하지 않게 표현되어 항류마티스 요법 동안 발달을 빠르게 역전시킬 수 있습니다. 진단 검색의 III 단계에서 실험실 및 도구 연구 데이터를 통해 병리학 적 과정의 활동을 확립하고 심장 및 기타 기관의 손상을 명확히 할 수 있습니다. 활성 류마티스 과정에서 실험실 테스트는 비특이적 급성기와 변경된 면역학적 매개변수를 나타냅니다. 급성기 지표: 백혈구 혈액 공식이 왼쪽으로 이동하는 호중구 증가증; 2-글로불린 함량의 증가에 이어 - 글로불린 수준의 증가; 피브리노겐 함량의 증가; C 반응성 단백질의 출현; ESR이 증가합니다. 면역학적 매개변수와 관련하여 항 연쇄상 구균 항체의 역가가 증가합니다(항-히알루로니다제 및 항스트렙토키나제 1:300 초과, 항-O-스트렙톨리신 1:250 초과). ECG는 때때로 리듬과 전도 장애를 나타냅니다: 일시적인 방실 차단(더 자주 I도 - P-Q 간격의 연장, 덜 자주 - II도), 수축기 외, 방실 리듬. 많은 환자에서 음의 치아가 나타날 때까지 T 파 진폭의 감소가 기록됩니다. 이러한 리듬과 전도 장애는 불안정하며 항류마티스 치료 과정에서 빠르게 사라집니다. ECG의 변화가 지속적이고 류마티스 발작이 제거된 후에도 남아 있다면 심근에 대한 유기적 손상에 대해 생각해야 합니다. 심전도 검사 중에 청진 데이터가 지정됩니다. 첫 번째 음색의 약화, 세 번째 음색의 출현, 수축기 잡음. 심장병이 형성되는 경우 판막 병변의 특성에 따라 PCG에 변화가 나타납니다. 류머티즘의 첫 번째 공격에서 X- 레이는 변화가 감지되지 않습니다. 소아 및 청소년의 심각한 류마티스성 심장병이 있는 경우에만 좌심실의 확장으로 인한 심장의 증가를 감지할 수 있습니다. 기존의 심장병을 배경으로 류마티스성 심장병이 발전함에 따라 엑스레이 사진은 특정 결함에 해당합니다. 원발성 류마티스성 심장병에 대한 심장초음파 연구에서는 특징적인 변화를 나타내지 않습니다. 심 초음파에서 심부전의 징후가있는 심각한 류마티스 성 심장 질환에서만 심근의 수축 기능 감소와 심장 강 확장을 나타내는 징후가 나타납니다. 진단. 다발성 관절염이나 심장 손상과 같은 가장 흔한 증상이 비특이적이기 때문에 원발성 류머티즘을 인식하는 것은 매우 어렵습니다. 현재 미국심장협회의 류머티즘에 대한 주요 기준과 부기준이 가장 널리 사용되고 있다. 두 가지 주요 기준 또는 한 가지 주요 기준과 두 가지 사소한 기준의 조합은 이전 연쇄상 구균 감염의 경우에만 류머티즘의 가능성이 더 높다는 것을 나타냅니다. 류머티즘이 점진적으로 시작되면서 1973년 AI Nesterov가 제안한 증후군 진단(표 2 참조)이 중요합니다. 임상 및 면역 증후군(불완전한 회복기의 징후, 관절통, 항 연쇄상 구균 항체 역가 증가, 단백질 이상 혈증 및 급성기 지표의 검출); 심혈관 증후군(심장염 및 심장 외 병변의 감지)(표 3 참조). 표 2 류머티즘의 기준
표 3 류머티즘의 정도
차동 진단. 류마티스성 다발관절염은 비류마티스성 관절염과 구별되어야 합니다(표 4 참조). 표 4 류마티스 및 비류마티스 다발관절염
류머티즘과 관련하여 다음과 같은 질병 및 증상이 의심됩니다. 1) 심내막염; 2) 심근염; 3) 심낭염; 4) 심장 결함; 5) 리듬 및 전도 장애; 6) 급성 및 만성 심부전; 7) 장기간의 아열성 상태; 8) 결절 홍반; 9) 환상 홍반; 10) 피하 결절; 11) 급성 알레르기성 다발관절염; 12) 무도증. 위에 나열된 임상 증후군 중 어느 것도 이 질병에 특이적이지 않습니다. 심장 병리와 류머티즘의 심장 외 주요 증상의 조합만이 류머티즘을 의심할 수 있는 이유를 제공합니다. 류마티스성 심장병 자체의 인식은 숨가쁨 및 심계항진, 피로, 심장의 통증 및 심장 리듬 장애, 소음, 때때로 갤럽 리듬 및 I 톤의 약화와 같은 증상을 기반으로 수행됩니다. 류마티스성 심장병 진단에서 매우 중요한 것은 ECG에서 병리를 식별하는 것입니다. 류머티즘에서는 심근염, 심낭염 및 심장 결함으로 인해 발생합니다. 동적 관찰을 통해 현재의 염증 과정을 나타내는 일시적인 것과 결함이 있는 경우 심장의 다양한 부분의 비대의 비가역적 변화를 구별할 수 있습니다. 치료. 심장병 발병 예방뿐만 아니라 치료에 대한 긍정적인 효과는 과정 유형, 병리학적 과정의 활동, 심장염의 중증도, 판막 심장 질환의 변형입니다. 심근 상태, 기타 조직 및 기관, 환자의 직업 등이 중요합니다. 따라서 류머티즘 치료의 전체 복합체는 면역 학적 항상성 회복을 목표로하는 항균 및 항염증 요법으로 구성됩니다. 합리적이고 균형 잡힌 식단을 사용하고 신체 활동에 대한 적응, 작업 준비, 복잡한 심장 결함이 있는 환자의 시기 적절한 외과 치료에 중점을 두는 것이 좋습니다. 류머티즘의 활성 단계 동안 모든 환자에게 페니실린(1일 200회 용량, 000시간마다 1-500 IU)이 표시되며, 이는 모든 유형의 A 연쇄상 구균에 살균 효과가 있습니다. 치료 과정은 류머티즘의 활성 단계에서 000 주이며, 향후에는 장기간 약물 bicillin-6 (4 단위)로의 전환이 필요합니다. 페니실린에 대한 불내성으로 하루에 2 번 에리트로 마이신 5mg을 처방 할 수 있습니다. 류머티즘의 활성 단계의 현대 치료에 사용되는 항염증 효과가있는 약물은 글루코 코르티코 스테로이드, 살리실산, 인돌 유도체, 페닐 아세트산 유도체 등입니다. 프레드니솔론은 20일 30-2mg으로 사용됩니다(2,5주 동안은 5-5일마다 7-1,5mg씩 감량하여 총 2-12개월 과정) III 및 II의 재발 및 재발 활동성 심장염으로 인한 심부전의 발병과 함께 다발성 장염 및 무도병과 함께 류마티스 성 심장 질환 과정의 정도 활동. 후자의 경우, 전해질 균형을 방해하는 능력이 거의 없기 때문에 하루 16-XNUMXmg의 트리암시놀론이 선호됩니다. 코르티코이드 약물은 물 - 소금 대사에 영향을 미치므로 염화칼륨 3-4g / day, panangin 등을 체액 저류와 함께 치료에 사용해야합니다 - 알도스테론 길항제 (veroshpiron 하루 최대 6-8 정), 이뇨제 (lasix 40-80 mg / day, furosemide 40-80 mg / day 등), 행복감 - 진정제 등 비 스테로이드 성 항염증제는 류머티즘에도 널리 사용됩니다. 아세틸 살리실산의 평균 복용량은 하루 3-4g, 덜 자주 5g 이상입니다. 살리실산염 사용에 대한 적응증: 1) 최소한의 활동 정도, 심장염의 경미한 중증도, 주로 심근염; 2) 류머티즘의 장기 치료, 잠복기의 의심; 3) 과정의 활동 감소 및 코르티코 스테로이드 사용 중단 및 병원에서의 치료 완료 후 장기간 치료; 4) 살리실산 염은 체액을 보유 할 수없고 혈전 형성을 방지하며 호흡기 센터의 자극제이기 때문에 심각한 심장 결함 및 순환 부전을 배경으로 발생하는 재발 성 류마티스 성 심장 질환; 5) 봄과 가을의 류머티즘 악화 가능성과 병발 감염 (항생제와 함께)을 겪은 후. Acetylsalicylic acid는 1일 3-4회 식후 1-3개월 이상 정상 내약성으로 부작용 조절에 따라 사용한다. 20년 이상 동안 류머티즘에 인돌아세트산 유도체 - 인도메타신의 성공적인 사용. 그것은 뚜렷한 치료 효과가 있습니다. 심장염의 주관적 증상 (심장통, 심계항진, 호흡 곤란)은 치료 8-10 일째에 사라지고 객관적 징후는 14-16 일째에 사라집니다. 다발성 관절염과 다발성 장염의 소멸은 훨씬 더 빨리 발생합니다. 류머티즘 치료에서 병원 - 클리닉 - 리조트의 세 가지 주요 단계의 조합이 중요합니다. 병원에서는 위에 열거한 약으로 치료를 합니다. 류머티즘의 활동을 줄이고 환자의 상태를 정상화 한 후 류마티스 요양원에서 치료하는 II 단계로 옮겨집니다. 이 단계의 주요 목표는 병원에서 개별적으로 선택되는 비 스테로이드 성 항염증제, 아미노 퀴놀린 유도체, 비실린-5, 재활 치료를 계속하는 것입니다. III기에는 진료실 관찰과 예방적 치료가 포함됩니다. 이것은 류마티스 과정의 활성 과정을 최종적으로 제거하기위한 치료 조치의 구현입니다. 심장 질환 환자의 순환 장애에 대한 대증 치료 수행; 재활, 작업 능력 및 고용 문제 해결; 류머티즘의 XNUMX차 예방과 질병의 재발의 XNUMX차 예방의 시행. 강의 2. 심혈관 질환. 심근병증. 확장성 심근병증 1. 심근병증 심근병증 - 원인을 알 수 없는 비염증성 성격의 원발성 심근 병변(특발성), 판막 결손 또는 심장 내 단락, 동맥 또는 폐 고혈압, 관상동맥 심장 질환 또는 전신 질환(예: 콜라게노즈, 아밀로이드증, 혈색소 침착증, 등) 및 질병의 마지막 단계에서 심각한 울혈 성 심부전 및 심장 리듬 및 개통의 복잡한 장애가 발생합니다. 심근병증의 분류는 다음과 같습니다. 1) 확장성 심근병증: a) 특발성; b) 독성; c) 감염성; d) 콜라겐과 함께; 2) 비대증; 3) 제한적; 4) 우심실의 부정맥 이형성증; 5) 동맥고혈압을 동반한 4가지 유형의 심근병증 중 하나의 조합. 2. 확장성 심근병증 확장성 심근병증(DCM)은 심장의 모든 방(주로 좌심실)의 확산 확장을 특징으로 하는 심장 근육의 질병으로, 심장의 펌핑 기능의 병리가 전면에 있고 결과적으로 , 만성심부전 심장의 근육벽은 변하지 않거나 다양한 정도로 비대해진 상태로 남아 있습니다. DCM의 발달에 선행한 질병 및 요인은 아래 표에 설명되어 있습니다(표 5 참조). 표 5 DCMP의 발달에 앞서 질병과 요인
이것은 심장 근육 손상의 가장 흔한 형태입니다. 발병률은 연간 5명당 8-100건입니다. 이 환자에 대한 명확한 가족력은 없습니다. 남성은 여성보다 000~2배 더 자주 아프다. 병인. 심장 근육의 염증 과정(심근염)의 결과로 각 세포의 사멸이 여러 부분에서 발생합니다. 이 경우 염증은 본질적으로 바이러스성이며 바이러스에 영향을 받은 세포는 신체의 외부 물질이 됩니다. 따라서 항원이 체내에 나타나면 항원 파괴를 목표로하는 복잡한 면역 반응 반응이 발생합니다. 점차적으로 죽은 근육 세포는 심근 고유의 신장성 및 수축성 능력이없는 결합 조직으로 대체됩니다. 기본적인 심근 기능의 상실로 인해 심장은 펌프 기능을 상실합니다. 이에 대한 반응(보상 반응)으로 심장의 방이 확장되고(즉, 팽창) 심근의 나머지 부분에서 두꺼워지고 압축이 발생합니다(즉, 비대가 발생합니다). 신체의 기관과 조직에 산소 공급을 증가시키기 위해 심박수가 지속적으로 증가합니다(동빈맥). 이 보상 반응은 심장의 펌프 기능을 일시적으로만 향상시킵니다. 그러나 심근 확장 및 비대의 가능성은 생존 가능한 심근의 양에 의해 제한되며 질병의 각 특정 사례에 따라 다릅니다. 과정이 대상 부전 단계로 전환됨에 따라 만성 심부전이 발생합니다. 그러나 이 단계에서 또 다른 보상 메커니즘이 작용합니다. 신체 조직은 건강한 신체에 비해 혈액에서 산소 추출을 증가시킵니다. 그러나이 메커니즘은 충분하지 않습니다. 심장의 펌핑 기능이 감소하면 정상적인 기능에 필요한 장기와 조직에 산소 공급이 감소하고 그 안의 이산화탄소 양이 증가하기 때문입니다. 질병의 말기에 심실 구멍에있는 환자의 2/3에서 정수리 혈전이 형성됩니다 (심장 펌핑 기능의 감소 및 심실의 불규칙한 심근 수축으로 인해 ), 폐 또는 전신 순환계에서 색전증이 발생합니다. 심장의 병리학적 및 병리학적 변화. 심장의 모양은 구형이되고 그 질량은 주로 좌심실로 인해 500에서 1000g으로 증가합니다. 심근은 연약하고 둔하며 결합 조직의 희끄무레 한 층이 눈에 띄며 비대 및 위축성 심근 세포의 특징적인 교대가 있습니다. 현미경으로 확산 섬유증이 감지되면 핵의 부피, 미토콘드리아 수, 골지 장치의 증식, 근원 섬유 수의 증가가 크게 증가하는 심근 세포의 위축 및 비대와 결합 될 수 있습니다 , 풍부하고 글리코겐 과립이 풍부한 소포체 리보솜과 관련이 있습니다. 임상 사진. 질병의 특별한 징후는 없습니다. 임상상은 다형성이며 다음에 의해 결정됩니다. 1) 심부전의 증상; 2) 리듬 및 전도 장애; 3) 혈전색전성 증후군. 이러한 모든 현상은 질병의 말기 단계에서 발생하므로 이러한 증상이 나타나기 전에 DCM을 인식하는 것은 상당한 어려움을 나타냅니다. 대부분의 경우 질병의 예후는 심장의 좌심실의 패배에 의해 결정됩니다. 심부전이 시작되기 전에 DCM은 잠복합니다. 이미 발병한 심부전의 가장 흔한 불만은 수행력 저하, 피로 증가, 운동 중 숨가쁨, 그리고 휴식 시의 불만입니다. 밤에는 마른 기침(심장 천식과 동일)이 발생하고 나중에는 전형적인 천식 발작이 나타납니다. 환자는 특징적인 협심증 통증을 나타냅니다. 전신 순환의 혼잡이 발생하면 오른쪽 hypochondrium에 무거움이 나타나고 (간 확대로 인해) 다리가 부어 오릅니다. 진단. 질병을 진단할 때 중요한 징후는 심장의 상당한 비대입니다(판막성 심장 질환이나 동맥성 고혈압의 징후는 없음). 심비대증은 타악기에 의해 결정되는 양방향으로 심장이 확장되고 정점 자극이 왼쪽과 아래쪽으로 이동함으로써 나타납니다. 심한 경우에는 질주 리듬, 빈맥, 승모판이나 삼첨판의 상대적 부전 소리가 들립니다. 20%의 경우 심방세동이 발생합니다. 혈압은 일반적으로 정상이거나 약간 높습니다(심부전으로 인해). 혈액과 소변에 대한 생화학적 연구는 다양한 독성 물질과 비타민 결핍을 감지할 수 있습니다. 도구적 연구 방법을 통해 다음을 감지할 수 있습니다. 1) 심비대 징후; 2) 중심 혈역학 지표의 변화; 3) 리듬 및 전도 장애. ECG에 특징적인 변화가 없거나 이동이 비특이적입니다. 이것은 심장 크기의 증가, 방실 다발 (그의 묶음)의 왼쪽 다리 앞쪽 가지의 봉쇄 또는 왼쪽 다리의 완전한 봉쇄 형태의 전도 장애 (경우의 15 %)의 징후입니다 ); 지속적인 동성 빈맥(심박수는 종종 분당 100회를 초과함). 심음 초음파는 수축기 심잡음(승모판 또는 삼첨판의 상대적인 불충분으로 인해)을 상당히 자주 감지하는 갤럽 리듬의 형태로 청진 데이터를 확인합니다. 폐순환의 혼잡으로 II 음색의 억양이 드러납니다. X-레이는 심실의 상당한 증가(종종 좌심방의 적당한 증가와 함께)와 폐(소) 순환의 혈액 정체를 나타냅니다. 폐 순환의 위반은 폐 혈관 패턴의 증가뿐만 아니라 폐 혈관의 압력 증가로 인해 형성되는 흉막 강에 transudate의 출현으로 나타납니다. 심장 초음파 검사 방법은 질병 진단의 주요 방법 중 하나입니다. 심장초음파검사는 두 심실의 확장, 좌심실 후벽의 운동저하, 수축기 동안 심실 중격의 역설적 움직임을 감지하는 데 도움이 됩니다. 또한 심장 초음파 검사를 통해 승모판의 변하지 않은 전단지의 움직임 진폭의 증가를 명확히 할 수 있습니다. 추가 도구 연구는 진단을 내리는 데 필수는 아니지만 그 결과를 통해 혈역학적 장애의 정도와 심근의 형태학적 변화의 특성을 자세히 설명할 수 있습니다. 심장의 방사성 동위원소 연구(심근 신티그라피)는 심장의 펌핑 기능 상태를 명확히 하고 죽은 심근의 영역을 결정하기 위해 수행됩니다. 중심 혈역학 지표에 대한 연구는 낮은 분 및 뇌졸중 부피(분 및 뇌졸중 지수), 폐동맥의 압력 증가를 나타냅니다. 심장초음파에서와 동일한 변화가 심장혈관조영술에서 감지됩니다. 라이브 심근 생검은 심근병증의 병인을 결정하는 데 유익하지 않습니다. 어떤 경우에는 바이러스 항원 또는 LDH 함량 증가, 미토콘드리아에 의한 에너지 생산 감소가 생검에서 감지될 수 있습니다. 그러나이 외과 적 방법은 질병의 원인과 추가 치료를 명확히하는 데 사용할 수 있습니다. 조작은 다음과 같이 수행됩니다. 국소 마취하에 큰 동맥과 정맥을 관통 (천공) 한 다음 끝에 작은 가위가있는 특수 도구가 과정을 따라 심장으로 전달됩니다. 심근생검과 관상동맥조영술(심장에 혈액을 공급하는 관상동맥에 조영제 주입)을 병행하면 환자의 관상동맥질환을 DCM과 유사한 증상을 보이는 질환으로 배제할 수 있게 된다. 이 두 연구는 X선 텔레비전 제어하에 수행됩니다. 차동 진단. 이는 주로 심근염 및 심근 이영양증, 즉 때로는 부당하게 이차성 심근병증이라고 불리는 상태에서 수행됩니다. 심근 생검은 확장성 심근병증 및 심장 질환의 감별 진단에 상당한 도움을 제공하며, 이는 다음과 같이 현저하게 증가합니다. 1) 심한 미만성 심근염에서 기질의 세포 침윤은 심근 세포의 영양 장애 및 괴사 변화와 함께 발견됩니다. 2) 심장 손상과 함께 발생하는 원발성 아밀로이드증(일차성 아밀로이드증의 심장병성 변이체)의 경우 근육 섬유의 위축과 함께 심근의 간질 조직에 아밀로이드가 유의하게 침착됩니다. 3) 혈색소 침착증(철 대사 장애로 인한 질병)의 경우 심근에서 철 함유 색소 침착이 발견되고 다양한 정도의 근섬유 위축 및 위축, 결합 조직의 증식이 관찰됩니다. DCM의 변형으로 약물 유발 및 독성 심근병증을 고려할 수 있습니다. 에탄올, 에메틴, 리튬, 카드뮴, 코발트, 비소, 이소프로테레놀 및 기타 독과 같은 수많은 약제가 심근에 독성 손상을 일으킬 수 있습니다. 심장 근육 조직의 조직 병리학 적 변화는 국소 영양 장애로 나타납니다. 미래에는 말초 염증 반응과 함께 미세 경색이 발생합니다. 독성 심근병증의 가장 두드러진 예는 과량의 맥주를 섭취하는 사람들에게 발생하는 심근병증입니다. 그것은 거품을 개선하기 위해 맥주에 첨가되는 코발트의 존재 때문입니다. 코발트는 비타민 B의 작용을 차단합니다1, 또한 세포의 효소 과정의 변화에 직접적인 영향을 미칩니다. 코발트 심근 병증의 급성기에는 수성 및 지방 변성의 존재, 세포 내 세포 소기관의 파괴 및 심근 세포의 국소 괴사가 주목됩니다. 미래에는 미만성 또는 소초점 간질 섬유증이 발생하고 최종 결과는 광범위한 흉터가 형성됩니다. 코발트 심근병증은 알코올성 심근병증보다 더 심각합니다. 진단이 제 시간에 이루어지면 환자의 임상 치료가 관찰됩니다. 알코올성 심근병증. 에탄올은 심근세포에 직접적인 독성 영향을 미칩니다. 또한 만성 에틸 중독으로 인해 영양이 부족한 경우가 많습니다. 알코올은 심근 세포에서 지방산의 순환을 유도한다는 것이 입증되었습니다. 그 이유는 활동에 필요한 에너지가 부족하기 때문입니다. 알코올 대사 과정에서 생성되는 아세트알데히드는 단백질 합성에 직접적인 독성 영향을 미치는 요인이 될 수 있습니다. 알코올 중독은 또한 잠복 바이러스의 활성화를 동반합니다. 거시적으로 심근은 연약하고 점토와 같으며 때로는 작은 흉터가 관찰됩니다. 관상동맥은 온전합니다. 현미경 검사는 근 위축증 (수경성 및 지방성), 위축 및 심근 비대, 아마도 심근 세포 용해 및 경화증의 병소의 존재를 보여줍니다. 심근의 영향을받는 부위는 변하지 않은 부위와 대조됩니다. 심장 생검 표본의 전자현미경 검사는 근형질 세망의 낭성 확장과 심근세포의 T-시스템을 보여주는데, 이는 알코올성 심근병증의 특징입니다. 알코올성 심근병증의 합병증 - 심실 세동 또는 만성 심부전, 혈전색전성 증후군으로 인한 급사. 치료. 심근병증의 치료는 그 발생의 구체적인 원인이 알려져 있지 않기 때문에 어려운 작업입니다. DCM 치료의 일반 원칙은 만성 심부전 치료와 크게 다르지 않습니다. 2차 DCM의 경우 기존 질환(심장판막질환 등)을 추가로 치료하고 DCM의 원인을 제거하기 위한 모든 조치를 취합니다. 본질적으로 우리는 임상 징후가 나타날 때만 심근 병증 환자의 치료에 대해 이야기 할 수 있습니다. 심부전에서 심장 배당체는 효과가 없습니다. 환자는 약물에 대한 과민증(글리코사이드 중독)이 빠르게 발생하므로 신체에서 빠르게 배설되는 배당체(strophanthin, isolanide)를 사용해야 합니다. 말초 혈관 확장제는 특히 수반되는 협심증 증후군(nitrong, sustak, nitrosorbide)에 매우 효과적입니다. 이 약물은 배당체 및 이뇨제로 치료하기 어려운 중증 심부전에 처방되어야 합니다. 협심증 증후군에서는 항협심증제, 바람직하게는 연장된 질산염(sustak, nitrong, nitrosorbide)을 사용해야 합니다. 아드레날린 차단제는 효과적입니다(심부전의 징후가 없는 경우에 처방됨). DCMP의 현대적인 외과 적 치료 방법 중 가장 효과적인 것은 심장 이식 (이식)입니다. 그러나 이 작업을 수행할 가능성은 상당히 제한적입니다. 이러한 이유로 현대 치료에서 심장 이식의 대안으로 DCM 환자의 기대 수명을 연장하기 위해 승모판 및 삼첨판 심장 판막의 기능 부전을 제거하기 위한 재건 수술이 개발되어 수행되고 있습니다. 이 판막의 부전을 수술로 제거하면 질병의 마지막 단계의 발병을 "느리게"하는 데 시간이 걸립니다. DCM 환자에서 심장 이식의 또 다른 대안은 크기를 줄이기 위해 좌심실을 부분적으로 제거하는 것이었습니다(Baptiste 수술). 얼마 전 DCMP 환자의 치료를 위해 심박 조정기의 특수 모델이 개발되어 심장 심실의 작업을 동기식으로 만들 수 있습니다. 이것은 심장의 심실을 혈액으로 채우는 것을 개선하고 심장의 펌핑 기능을 증가시킵니다. 별도의 문제는 어린이의 DCM으로 간주되어야 하며 이는 연간 어린이 5명당 10-100건입니다. 이 질병이 유아를 포함하여 다양한 연령대에서 발생할 수 있다는 점은 주목할 만합니다. 어린이 그룹에 대한 연구에서 얻은 데이터는 다음과 같습니다. 환자는 000가지 치료 옵션(프레드니솔론 단독 요법, 디곡신 단독 요법 또는 프레드니솔론 + 디곡신)을 받았습니다. 치료의 효과는 치료 전후의 심박수, 호흡수, 박출률 및 수축률의 상태를 기준으로 평가하였다. 얻어진 결과를 분석한 결과, 코르티코스테로이드와 배당체(프레드니솔론 및 디곡신)의 조합으로 소아의 확장성 심근병증 치료에 가장 큰 효과가 나타납니다. 주요 치료 과정(3일 동안 2일 28mg/kg의 프레드니솔론 투여, 디곡신) 완료 후, 심박수와 호흡 곤란의 감소가 현저하게 감소했습니다. 프레드니솔론 단독 요법의 배경에 대해 심박수 감소가 발생합니다. 디곡신 단독 요법은 빈맥과 호흡곤란을 감소시킵니다. 소아에서 세포증식억제제를 처방하는 것이 권장되지 않는다는 점을 감안할 때, 상당한 수의 치료 합병증이 관찰되었기 때문에 소아과에서는 확장성 심근병증에서 코르티코스테로이드 호르몬과 함께 지속형 심장 배당체를 사용하는 것이 더 최적입니다. 예방. DCM 예방에는 알코올, 코카인을 피하고 종양 화학 요법 중에 심장 매개변수를 주의 깊게 모니터링하는 것이 포함됩니다. 어릴 때부터 몸을 단단하게 하는 것이 좋다. 알코올성 DCM의 완전한 금주는 심장 수축성을 개선하고 심장 이식의 필요성을 제거할 수 있습니다. 대부분의 경우 진단이 심부전 단계에서 발생한다는 사실은 치료에서도 부정적인 결과를 초래할 수 있습니다. 확장성 심근병증의 조기 진단은 매년 건강 검진 중에 시행하는 무작위(선별) 심장초음파검사와 이 질환을 앓고 있는 유전인자를 검사할 때 시행할 수 있습니다. 이 경우 DCM의 약물 치료 효과를 높일 수 있습니다. 강의 № 3. 심혈관 질환. 비대성 심근병증 비대성 심근병증(HCM)은 우심실의 공동으로 심실 중격(IVS)이 돌출되어 있는 벽의 대규모 비대를 특징으로 하는 심실 심근(주로 왼쪽)의 비관상동맥 질환으로, 이는 상당히 두꺼워질 수 있습니다 , 심실 내부 용적의 감소, 심실 심근의 정상 또는 증가된 수축 및 이완 장애(이완기 기능 장애). 가장 흔한 것은 심실 중격의 고립성 비대(격리된 비대 대동맥하 협착증 - IHSS) 또는 심실의 정점 부분입니다. 분류. 비대의 국소화에 의한 HCM 분류(ED Wigle et al., 1985 추가). I. 좌심실 비대. 1) 심실의 개별 벽 또는 부분의 심근 비대가 발생하는 비대칭 비대(IVS 비대 포함 - 좌심실 유출로 폐쇄가 있거나 없는 90%, 심실 - 1%, 정점 좌심실 비대 - 3%, 자유벽 비대) 좌심실 및 IVS의 후부 - 1%). 2) 심근의 비대가 심실의 모든 벽으로 확장될 때 좌심실의 대칭(동심) 비대가 5%의 경우에서 발생합니다. Ⅱ. 췌장의 비대. 심근 비대가 심장 심실에서 정상적인 혈액 유출을 방해하는 경우 폐쇄형 HCM을 말합니다. 다른 경우에는 HCM이 방해가 되지 않습니다. 병인학. 이 질병은 선천적일 수도 있고 후천적일 수도 있습니다. 선천성 HCM은 상염색체 우성 방식으로 유전됩니다. 동일한 계열 내에서 HCM의 다양한 형태와 변형이 관찰될 수 있습니다. 대부분의 경우 심실 중격의 비대칭 비대가 유전됩니다. HCM의 후천적 형태는 동맥성 고혈압의 병력이 있는 노인 환자에서 발생합니다. 유병률은 0,02-0,05%입니다. 획득한 HCM의 개발 이유는 완전히 이해되지 않았습니다. 제안된 가설 중 하나에 따르면, 태아기에 HCM을 획득한 개인은 심장 활동, 특히 심박수 조절에 관여하는 심장의 아드레날린 수용체에 결함이 발생합니다. 결과적으로 심박수를 증가시키는 노르에피네프린 및 유사 호르몬에 대한 감수성이 크게 증가하여 심근 비대의 발달 및 결국 HCM에 영향을 미칩니다. 병리조직학적 사진. 심근세포의 심근세포와 근원섬유의 혼란스럽고 부정확하며 혼란스러운 배열, 심근 섬유증은 심장 근육의 건축학을 위반하는 것입니다. 병인. 혈역학적 장애는 심장의 확장기 기능 장애로 인해 발생합니다. 확장기 동안 심실(특히 왼쪽)의 밀도와 강성으로 인해 혈액이 불충분하게 흐르고 이로 인해 확장기 혈압이 급격히 상승합니다. 증가된 심근경직과 증가된 심실내압은 수축기 동안 심실에서 분출되는 혈액의 양을 줄입니다. 신체의 기관과 조직에 산소를 적절하게 전달하려면(심혈관계 기능이 정상적임), 부하를 가하려면 심장에서 혈액 방출이 증가해야 합니다. 따라서 부하에 따라 심박수가 증가합니다. HCM의 발달로 심장에 혈액을 채우는 것도 휴식을 취하는 데 고통을 겪고 운동 기간 동안 심박수가 증가하면 더욱 부정적인 영향을 받습니다. 그 결과 HCM에서 운동하는 동안 심장의 펌프 기능이 적절하게 증가하지 않습니다. HCM의 신체 활동은 심실 내 압력의 증가에 영향을 미치므로 위에 위치한 좌심방과 작은 (폐) 순환 혈관의 압력이 증가합니다. 이러한 조건에서 좌심방의 기능 항진과 비대가 발생하고 나중에는 폐 고혈압 ( "수동적")이 발생합니다. 그 결과 부하의 정도에 비례하는 숨가쁨이 발생합니다. 운동하는 동안 좌심실에서 혈액이 배출되는 것은 부하의 증가와 일치하지 않기 때문에 심장 근육 자체에 영양을 공급하는 관상 동맥의 혈류가 고통을 받기 시작합니다. 또한 HCM에서 상당한 양의 비대 심근과 건강한 사람과 동일하게 유지되는 관상동맥 혈액 공급 가능성 사이에 불일치가 있다는 것도 중요한 역할을 합니다. 관상 동맥을 통한 혈류의 감소는 왼쪽 어깨 뼈 아래의 왼쪽 팔로 방사되는 가슴의 중앙과 왼쪽 절반에 협심증이 발생합니다. 숨가쁨과 마찬가지로 협심증도 육체 노동에 의해 유발됩니다. 운동 중 HCM의 경우 대뇌 혈액 공급도 저하되어 실신이 발생합니다. 운동 중 심실 내 압력의 증가를 줄이기 위해 보상 메커니즘이 있으며, 그 작동은 좌심방의 공동이 확장되고 벽의 두께가 증가한다는 사실을 기반으로합니다. 결과적으로 운동 중에 좌심실에 혈액이 추가로 채워집니다. 그러나 이것은 "펌프"로서의 좌심방의 예비가 미미하고 좌심방의 공동의 현저한 확장으로 인해 심방 세동이 발생하기 때문에 이것은 일시적인 보상 일뿐입니다. 임상 사진. HCM은 증상이 매우 다양하여 오진을 일으키는 것이 특징입니다. HCM에 대한 불만의 존재와 시기는 주로 HCM의 형태와 병변의 위치라는 2가지 요소에 의해 결정됩니다. 심장의 가장 강력한 방은 좌심실이므로 심근벽의 비대화로 인해 불만이 오랫동안 나타나지 않을 수 있습니다. 심장 우심실의 단독 손상은 극히 드뭅니다. 비폐쇄형 HCM에서 심실에서 혈액이 유출되는 것을 방해하지 않는 경우 환자는 불만을 표시하지 않을 수 있습니다. 때때로 호흡 곤란(상당한 신체 활동으로), 심장 활동 중단, 불규칙한 심장 박동이 있을 수 있습니다. 폐쇄성 형태의 HCM에서는 심실에서 혈액이 유출되는 것을 방해하는 장애물이 있기 때문에 운동 중 심장에서 혈액 배출이 현저히 감소합니다. 이 경우 전형적인 불만은 운동 시 숨가쁨, 협심증 및 실신입니다. 이 질병은 발병 순간부터 불만이 천천히 진행되는 것이 특징입니다. 호소(심장 부위와 흉골 뒤의 통증)와 연구 데이터(강렬한 수축기 잡음)의 유사성으로 인해 류마티스성 심장 질환과 관상 동맥 심장 질환이 가장 자주 오진됩니다. HCM의 임상 사진은 다음과 같습니다. 1) 심실 심근 비대의 징후(주로 왼쪽); 2) 이완기 심실 기능이 불충분하다는 징후; 3) 좌심실 유출로 폐쇄의 다양한 징후. 진단. 진단 검색 과정에서 가장 중요한 것은 수축기 잡음, 변경된 맥박 및 변위된 근단 자극을 감지하는 것입니다. 폐쇄성 HCM 환자의 심장 청진상에는 여러 가지 특징이 있습니다. 수축기 잡음(출혈 잡음)의 최대 소리는 Botkin 지점에서 결정되고 심장의 정점에서 잡음의 심각도는 다음과 비례합니다. 방해의 정도, 환자가 갑자기 일어설 때와 Valsalva 테스트 중에 악화가 발생합니다. II 톤은 항상 유지됩니다. 목의 혈관에는 소음이 발생하지 않습니다. 맥박은 일반적으로 높고 빠릅니다. 이것은 수축기 시작 시 좌심실의 유출로가 좁아지지 않기 때문이지만 강력한 근육이 수축하면 유출로의 "기능적" 협착이 나타나며 그 결과 맥박이 파도가 일찍 감소합니다. 사례의 약 1/3에서 정점 박동은 "이중"특성을 가지고 있습니다. 처음에는 촉진시 좌심방의 수축에서 타격이 느껴진 다음 좌심실의 수축에서 느껴집니다. 이러한 정점 박동의 특성을 식별하기 쉽도록 촉진은 환자가 왼쪽으로 누워 있을 때 가장 잘 수행됩니다. HCM 진단을 위해 심장 초음파 데이터가 가장 중요하므로 질병의 해부학 적 특징, 심근 비대의 중증도, 좌심실의 유출로 폐쇄를 명확히 할 수 있습니다. 다음과 같은 징후가 나타납니다. IVS의 비대칭 비대, 상위 XNUMX/XNUMX에서 더 두드러진 운동 저하; 승모판의 전방 소엽이 전방으로 수축기 운동; 확장기에서 승모판의 전엽과 IVS의 접촉. 비특이적 징후는 좌심방의 비대, 좌심실 후벽의 비대, 승모판의 전엽의 이완기 덮개의 평균 속도 감소입니다. ECG에서 특정 변화는 충분히 발달된 좌심실 비대에서만 발견됩니다. 24시간 동안 ECG를 기록(홀터 모니터링)하여 기존의 심장 리듬 장애를 감지합니다. 자전거 에르고미터 또는 러닝머신을 사용하여 신체 활동을 하는 ECG 테스트를 통해 질병의 증상의 중증도와 예후를 평가하고 적절한 치료법을 개발할 수 있습니다. IVS의 고립된 비대는 왼쪽 가슴 리드(V5-6)에서 Q파의 진폭을 증가시켜 심근 경색으로 인한 국소 변화로 감별 진단을 복잡하게 만듭니다. 그러나 Q파의 폭이 작으면 심근경색을 배제할 수 있으며 좌심방의 혈역학적 과부하가 진행되는 과정에서 ECG는 좌심방 비대의 징후를 보일 수 있습니다. 진폭에서 리드 V에서 0,10상 P파의 출현1 두 번째 위상은 진폭과 지속 시간이 증가했습니다. X 선 진단은 좌심실과 좌심방의 증가, 대동맥의 하행 부분의 확장을 결정할 수있는 질병의 진행 단계에서만 중요합니다. 심음도에서 대동맥 구멍의 협착과 HCM의 감별 신호인 I 및 II 톤의 진폭이 보존되며 다양한 중증도의 수축기 잡음도 감지됩니다. 침습적 연구 방법(심장 왼쪽 부분의 탐침, 조영제 혈관 조영술)은 현재 의무 사항이 아닙니다. 심장초음파검사는 진단을 내리는 데 매우 신뢰할 수 있는 정보를 제공하기 때문입니다. 그러나 때로는 이러한 방법이 논란의 여지가 있는 경우 진단을 명확히 하거나 환자가 수술을 준비할 때 사용됩니다. 심장 탐침은 X선 텔레비전 제어 하에 사용됩니다. 방법을 수행하는 기술: 심장강에 특수 카테터를 추가로 도입하여 국소 마취하에 큰 동맥에 구멍을 뚫어 좌심실과 대동맥에서 출발하는 대동맥 사이의 압력 구배(차이)를 측정합니다. 일반적으로 이 그라디언트는 없어야 합니다. 그러나 HCM의 경우 좌심실과 대동맥 사이에 50~150mmHg의 압력 차이가 있습니다. Art., 좌심실 공동의 이완기 말 압력이 최대 18mmHg까지 증가합니다. 미술. β-차단제를 도입한 후 압력 구배가 감소합니다. 또한 심장의 소리를 내는 동안 조영제를 심실강에 주입하여(심실조영술) 해부학적 특징을 연구합니다. 많은 환자(원칙적으로 40세 이상)에서 협심증의 병인을 명확히 하고 수반되는 관상동맥 질환을 배제하기 위해 심장 수술 전에 관상 동맥 혈관 조영술(관상 혈관 조영술)을 동시에 사용합니다. 치료. HCM에 대한 약물 치료의 기본은 확장기에서 심실로의 혈류를 개선하는 약물입니다. 이러한 약물은 β-차단제 그룹(아나프릴린, 아테놀롤, 메토프롤롤 및 프로프라놀롤, 160일 320-XNUMXmg 등)과 칼슘 이온 길항제 그룹(베라파밀, 그러나 주의)입니다. 노보키나미드와 디소피라미드는 또한 심박수를 감소시키고 항부정맥 효과가 있습니다. 치료 초기에는 소량의 약물을 사용한 후 환자가 견딜 수 있는 최대 용량까지 점차적으로 복용량을 늘립니다. β-차단제는 당뇨병, 기관지 천식 및 기타 질병에 주의해서 사용됩니다. 이러한 약물로 치료할 때 혈압과 맥박의 지속적인 모니터링이 필요합니다. 위험한 것은 90/60mmHg 미만의 압력 감소입니다. 미술. 분당 55 미만의 심박수. 환자가 β-차단제나 칼슘이온 길항제로 치료할 수 없는 위험한 리듬 장애를 가지고 있는 경우, 이러한 환자의 치료에 다른 항부정맥제가 추가로 사용됩니다. 항응고제의 임명은 발작성 부정맥 및 심방 세동뿐만 아니라 심장 방 (와파린 등)에 혈전이있는 경우 권장됩니다. 이러한 약물로 치료하는 동안 혈액 응고 시스템의 여러 지표를 정기적으로 모니터링해야합니다. 항응고제의 과다 복용으로 외부 (비강, 자궁 등) 및 내부 출혈 (혈종 등)이 가능합니다. 폐쇄성 HCM 환자에서 약물 치료가 효과가 없거나 좌심실과 대동맥 사이의 기울기가 30mmHg 이상인 경우 수술적 치료를 시행합니다. 미술. (근 절제술 또는 근절제술이 수행됩니다-좌심실의 비대 심근의 일부를 절제 또는 제거). 승모판 교체 및 비수술적 IVS 절제도 수행됩니다. 예방. 모든 HCM 환자, 특히 폐쇄성 형태의 환자는 단기간 동안 신체 활동을 크게 증가시킬 수 있는 스포츠(운동, 축구, 하키)를 금합니다. 질병의 예방은 조기 진단에 달려 있어 질병의 조기 치료를 시작하고 심각한 심근 비대증의 발병을 예방할 수 있습니다. 환자의 유전적 친척에 대해 심장초음파검사를 시행하는 것이 필수입니다. 매년 건강검진 시 실시하는 ECG, EchoCG 선별검사도 진단에 중요합니다. 폐쇄성 HCM 환자의 경우, 폐쇄가 있으면 생명을 위협하는 상태가 발생하기 위한 조건이 생성되므로 감염성 심내막염(항생제 예방 조치 등)을 예방하는 것이 필요합니다. 강의 № 4. 심혈관 질환. 제한성 심근병증 제한성 심근병증(RCMP) - (라틴어 제한에서 - "제한") - 다양한 이유로 인해 뚜렷한 섬유증 및 탄력 상실의 결과로 충전에 고정된 제한이 있는 심근 및 심내막 질환 그룹 이완기의 심실. 심실 충전은 조기 충전 단계에서 수행되며 이후 심실 내압이 안정화됩니다. 이 질병은 심장에 혈액 공급이 충분하지 않아 만성 심부전으로 이어집니다. 제한성 심근병증은 모든 심근병증 중에서 가장 적게 연구되고 가장 흔하지 않습니다. RCMP는 다음을 포함합니다: Lefler의 정수리 섬유형성 심내막염(온대 기후를 가진 국가에서 발견, W. Loffler et al., 1936에 의해 기술됨) 및 심근내막 섬유증(열대 아프리카 국가에서 발견, D. Bedford et E. Konstman에 의해 기술됨). 이전에는 두 개의 독립적인 병리학적 과정으로 간주되었습니다. 그러나 이러한 질병의 병리학 적 그림은 거의 다릅니다. RCM의 원인. 원발성 RCM은 매우 드물며, 그 발생의 유일하게 입증된 원인은 소위 과호산구성 증후군(레플러병, 레플러의 두정엽 섬유형성 심내막염)입니다. 주로 30~40세 남성에게 발생합니다. 과호산구성 증후군의 경우, 심내막의 염증이 발생하며, 이는 시간이 지남에 따라 심내막이 상당히 압축되고 인접한 심근에 거칠게 접착되어 심장 근육의 신장성이 급격히 감소하게 됩니다. 레플러 증후군은 또한 6개월 이상 지속되는 호산구 증가증(1500mm당 1개 호산구)을 특징으로 합니다.3), 내부 장기(간, 신장, 폐, 골수) 손상. 대부분의 경우 RCMP의 기원은 다른 이유로 인해 이차적이며 그 중 가장 흔한 것은 다음과 같습니다. 1) 아밀로이드증 - 신체의 단백질 대사 위반과 관련된 질병; 동시에 다양한 장기의 조직에서 비정상적인 단백질 (아밀로이드)이 형성되어 대량으로 침착됩니다. 심장이 손상되면 아밀로이드는 수축성과 확장성을 감소시킵니다. 2) 혈색소 침착 - 혈액 내 철분 함량의 증가와 함께 신체의 철 대사를 위반하고 그 초과분은 심근을 포함한 많은 기관과 조직에 침착되어 확장성이 감소합니다. 3) 유육종증 - 기관 및 조직에 세포 군집(육아종)이 형성되는 것을 특징으로 하는 병인을 알 수 없는 질병; 폐, 간, 림프절 및 비장이 가장 자주 영향을받습니다. 심근에서 육아종이 발생하면 확장성이 감소합니다. 4) 심내막 질환(심내막 섬유증, 심내막 섬유탄성증 등), 심내막의 현저한 비후 및 압축이 있을 때 심근 확장성의 급격한 제한을 초래합니다. 특히 심내막의 섬유탄성증은 유아에게만 발생할 수 있습니다. 이 질병은 중증 심부전의 조기 발병으로 인해 생명과 양립할 수 없습니다. 병인. RCM을 사용하면 심근 순응도가 여러 가지 이유로 어려움을 겪습니다. 결과적으로 심실에 혈액이 채워지는 양이 감소하고 심실내압이 크게 증가합니다. 그러나 HCM과 달리 제한성 심근병증에서는 보상성 심근비대가 발생할 가능성이 적습니다. 따라서 일정 시간이 지나면 폐 순환이 정체되고 심장의 펌핑 기능이 감소하여 신체의 점진적인 체액 정체, 다리의 지속적인 부종, 간비대 및 복수가 발생합니다. 심내막의 압축이 방실 판막(승모판 및 삼첨판)으로 확장되는 경우, 이는 부전의 발달로 인해 악화되고 수축성 및 확장성이 감소하여 심장강의 혈전증을 유발합니다. 혈류와 함께 이러한 혈전 조각이 퍼지면 혈전 색전증 및 큰 혈관 막힘, 내부 장기의 심장 마비가 발생할 수 있습니다. 심근의 병리학 적 개재물이 심장의 전도 시스템 영역으로 퍼지면서 봉쇄의 발달과 함께 심장 충동의 전도에 다양한 장애가 나타날 수 있습니다. RCMP를 사용하면 다양한 유형의 부정맥도 꽤 자주 관찰됩니다. 위의 내용을 바탕으로 병리학 적 관점에서 질병은 3 단계로 진행된다는 결론을 내릴 수 있습니다. I기 - 괴사 - 심근 및 기타 기관의 호산구성 침윤. II기 - 혈전성 - 좌심실 및 우심실의 공동에 혈전 형성, 혈전색전성 합병증의 발병 및 주로 정점 부위 및 방실 판막 근처에서 심내막이 점진적으로 두꺼워짐. III 단계 - 섬유질, 최대 수 밀리미터까지 심내막이 두꺼워지는 것을 특징으로 하는 심근 섬유증은 주로 심내막하 영역에서 나타납니다. 공동은 조직화된 혈전, 승모판 첨두의 섬유증, 승모판 역류로 인해 부분적으로 소멸됩니다. 심방 확장을 발음합니다. 제한적 이완기 장애가 관찰됩니다. 임상 사진. 질병의 증상은 극도로 다형성이며 작거나 큰 원의 순환 장애 증상에 의해 결정됩니다 (우심실 또는 좌심실의 주요 손상에 따라 다름). 불만이 없을 수도 있고 폐 또는 전신 순환의 혼잡으로 인한 것일 수도 있습니다. 환자들은 일반적으로 운동 중 처음 나타나는 숨가쁨을 호소하며, 질병이 진행됨에 따라 휴식 시 숨가쁨이 관찰됩니다. 심장의 펌핑 기능 감소로 인해 환자는 피로와 부하에 대한 내성이 약하다고 불평합니다. 시간이 지남에 따라 다리의 부기, 간 비대 및 복부의 수종이 나타납니다. 주기적으로 불규칙한 심장 박동이 나타나고 지속적인 봉쇄가 발생하면 실신이 발생할 수 있습니다. 질병 발병의 첫 번째 단계(괴사)는 발열, 체중 감소, 기침, 피부 발진 및 빈맥의 출현이 특징입니다. 진단. RCM을 인식하는 것은 매우 어렵습니다. 다수의 유사한 질병(Abramov-Fiedler 유형의 특발성 심근염, 삼출성 심낭염, 판막 심장 결함 등)을 배제한 후에만 이 병리에 대해 자신 있게 말할 수 있습니다. RCMP 환자를 검사할 때 울혈성 심부전의 특징적인 증상(부종, 간비대 및 복수)과 목 정맥의 뚜렷한 맥동이 발견됩니다. 후자는 빈약한 심근 확장성으로 인해 심장에 혈액 공급이 어렵기 때문입니다. 청진 중에 심장 확대, 부드러운 수축기 후기 잡음, 초기 III 톤(확장기 동안 심실이 빠르게 채워지기 때문에)을 감지하는 것이 매우 중요합니다. 심장의 잡음은 방실 판막 기능 부전 환자에서도 감지됩니다. ECG 연구는 심실 심근의 중등도 비대, 심장 충동의 리듬 및 전도의 다양한 장애, ECG의 T 파의 비특이적 변화를 보여줍니다. 심초음파 검사는 질병을 진단하는 가장 유익한 방법 중 하나입니다. 이완기 동안 승모판의 전엽의 바깥쪽으로의 빠른 초기 움직임과 좌심실의 후벽의 빠른 움직임. 자기 공명 영상을 사용하면 심장의 해부학에 대한 정보를 얻고 심근의 병리학적 내포물을 결정하며 심장 내막의 두께를 측정할 수 있습니다. 중심 혈역학의 매개변수를 조사할 때 양 심실의 증가된 충전 압력이 결정되고 왼쪽의 최종 압력이 우심실의 압력을 초과합니다. 심실 조영술은 좌심실의 수축 증가, 벽의 부드러운 윤곽, 때로는 정점에 충만 결함이 있음을 보여줍니다(소실의 증거). 어떤 경우에는 유두 근육 부위의 함몰이 결정됩니다. 판막 기능 부전, 특히 승모판 또는 삼첨판의 징후가 있습니다. 차동 진단. RCM의 감별 진단에서는 협착성 심낭염의 외부 증상과 질병의 유사성을 고려하는 것이 매우 중요하지만 이러한 질병의 치료 방법은 정반대입니다. 심근 및 심내막의 생체내 생검은 일반적으로 심장 탐침과 동시에 사용되며, 이는 질병의 성격과 추가 치료를 명확히 하는 데 더 많은 정보를 제공합니다. 극히 드물지만 위의 진단 방법으로 RCM과 협착성 심낭염을 구별할 수 없는 경우 수술대에서 심낭을 직접 검사합니다. RCMP가 있는 모든 환자는 질병의 비심장적 원인을 결정하기 위해 포괄적인 임상, 생화학적 및 추가 검사가 필요합니다. 치료. 질병의 치료는 심각한 어려움을 안겨줍니다. 심부전 치료에 사용되는 대부분의 약물은 질병의 특성상 심근 순응도를 크게 개선하는 것이 불가능하기 때문에 원하는 결과를 얻지 못할 수 있습니다(경우에 따라 칼슘 이온 길항제를 처방함). 이러한 목적으로). 이뇨제(알닥톤)는 체내의 과도한 체액을 제거하는 데 사용됩니다. 지속적인 전도 장애를 제거하려면 영구 심박조율기를 설치(이식)해야 할 수도 있습니다. 이것은 유육종증 및 혈색소 침착증과 같은 질병으로 인해 발생하여 XNUMX차 RCMP가 발생하며 자가 치료 대상입니다. 유육종증의 치료에는 호르몬제(프레드니솔론 등)가 사용되며, 혈색소증에는 규칙적인 유혈(체내 철분 농도 감소)이 사용됩니다. 심근 아밀로이드증의 치료는 발생 원인에 직접적으로 의존합니다. 심방의 혈전증에 항응고제를 사용하는 것이 좋습니다. 심내막 손상으로 인한 RCMP의 경우 외과적 치료가 필요합니다. 수술 중 가능한 경우 변화를 겪은 심내막 부분을 절제합니다. 어떤 경우에는 방실 판막이 불충분하면 보철물이 수행됩니다. 일부 형태의 아밀로이드 심근 손상은 심장 이식으로 치료됩니다. RCMP 예방. 불행하게도 이 질병에 대한 예방 조치는 제한적입니다. 주로 예방 가능한 아밀로이드증, 유육종증, 혈색소증 등의 원인을 조기에 파악하는 것이 필요하며, 이러한 목표를 달성하기 위해서는 매년 국민건강검진을 실시하는 것이 매우 중요합니다. 강의 5. 심혈관 질환. 감염성 식도염 감염성 심내막염(IE) - 심장 판막 장치의 용종증 궤양성 병변(종종 판막 기능 부전이 발생함) 또는 정수리 심내막(덜 자주, 대동맥 또는 가장 가까운 큰 동맥의 내피가 영향을 받음)으로 구성된 질병. 이 질병은 다양한 병원성 미생물에 의해 발생하며 신체의 변경된 반응성을 배경으로 내부 장기 (신장, 간, 비장)의 전신 병변을 동반합니다. 지금까지 다양한 출판물에서 "세균성 심내막염", "지속성 패혈성 심내막염"이라는 용어가 이러한 병리학적 과정을 가리키는 것으로 나타났습니다. 그러나 세균, 리케차, 바이러스 및 곰팡이와 같은 다양한 미생물에 의해 유발되는 질병의 원인을 더 잘 반영하는 용어는 "감염성 심내막염"이라는 용어를 대체했습니다. IE 환자의 수는 전 세계적으로 증가하고 있습니다. 이것은 병리학적으로 변형된 환자에서 감염이 더 쉽게 발생한다는 사실의 결과로 소위 위험 그룹(동맥경화증, 류마티스성, 외상성 판막 손상, 심장 또는 판막 결손, 심실 중격 결손, 대동맥 협착이 있는 환자)의 존재 때문입니다. 판막 또는 심내막. 병인학. 질병의 병원성 원인 물질은 가장 흔히 구균 미생물 그룹입니다 - 연쇄상 구균 (viridans streptococcus는 이전에 90 %의 경우에서 분리되었습니다), 포도상 구균 (황금색, 흰색), 장구균, 폐렴 구균. 최근에는 항생제의 광범위한 사용으로 인해 미생물 병원체의 범위가 변화되었습니다. 이 질병은 그람 음성균(Escherichia coli, Pseudomonas aeruginosa, Proteus, Klebsiella)에 의해 발생할 수 있으며 병원성 진균, Sarcinus, Brucella 및 바이러스의 중요한 역할에 대한 증거가 나타났습니다. 이러한 병원체로 인한 질병은 더욱 심각하며, 특히 진균 감염으로 인한 심내막염(보통 항생제의 비합리적인 사용으로 인해 발생)이 더욱 심각합니다. 그러나 많은 환자에서는 질병의 진정한 원인이 발견되지 않았습니다(혈액배양 결과가 음성인 빈도는 20-50%입니다). 종종 감염은 인공 판막 부위에서 발생합니다. 소위 인공 IE는 주로 심장 판막 교체 수술 후 2개월 이내에 발생합니다. 이 경우 질병의 원인 물질은 연쇄상 구균 성질을 갖는 경우가 가장 많습니다. 따라서 IE에서 감염 및 균혈증의 원인은 매우 다릅니다(구강 수술, 비뇨생식기 부위의 수술 및 진단 절차, 심장 혈관계의 외과적 개입(판막 교체 포함), 정맥 내 카테터 장기 체류, 빈번한 정맥 주입 및 내시경 연구 방법, 만성 혈액 투석 (동정맥 션트), 정맥 내 약물 투여). 손상되지 않은 판막에서 발생하는 소위 XNUMX차 IE와 심장 및 판막 장치의 선천적 및 후천적 변화의 배경인 XNUMX차 심내막염에 대한 IE가 있습니다. 이러한 변화로 인해 환자를 심장 결함(선천성 및 후천성), 승모판 탈출증, 동정맥 동맥류, 경색 후 동맥류, 션트, 심장 및 대형 혈관 수술 후 상태와 같은 별도의 위험 그룹으로 구분할 수 있습니다. 병인. IE의 발병 메커니즘은 복잡하고 연구가 충분히 이루어지지 않았지만 질병 발병의 주요 포인트를 확인할 수 있습니다. 면역 반응의 변태, 다양한 내인성 및 외인성 요인으로 변경된 체액 및 국소 (세포) 면역의 영향으로 신체에 감염의 초점이 있으면 균혈증이 발생합니다. 혈액에서 미생물이 심장 판막으로 들어가 감염의 XNUMX차 초점을 만듭니다. 심내막에 미생물의 고정 및 번식은 여러 가지 요인에 의해 촉진됩니다. 조직 및 판막 표면의 이전 변화, 혈류의 직접적인 손상 효과의 영향으로 발생하는 혈전 덩어리의 존재 심장 내 순환이 기존 심장 질환의 상태를 변경할 때. 동시에 다양한 혈액 세포(혈소판 등)가 외상성 손상 부위에 "접착"하여 판막에 매달려 있는 고드름과 유사한 세포 성장을 형성합니다. 이 식물은 혈관층에 침투한 감염에 사용할 수 있게 됩니다. 큰 압력 구배의 발생으로 인한 판막의 변형, 구멍의 협소함 및 혈류 속도의 변화는 또한 감염성 초점의 형성과 함께 감염원이 심내막으로 유입되는 데 기여합니다. 이전에 손상되지 않은 판막이 손상되면 이 판막의 개별 섹션(부기가 나타남), 삼출성 또는 증식성 과정("간질 판막염" - 전임상 단계)의 정상적인 특성을 방해하는 변화가 발생합니다. 질병의 발달에서 III 단계를 구별 할 수 있습니다. XNUMX단계(전염성 독성)는 다양한 정도의 중독으로 진행됩니다. 박테리아가 증식하고 판막이 파괴되어 심장병이 발병합니다. 같은 단계에서 감염의 혈행성 확산으로 인해 프로세스의 일반화가 종종 발생합니다. 첨판 조각이나 미생물 군체가 판막에서 분리될 수 있고 첨판이 파열될 수 있습니다. 판막 미생물 식생 조각의 분리는 감염된 색전이 혈관층의 다양한 부분으로 유입되는 데 기여하고 패혈증 증상을 악화시킵니다. 판막 조각이나 미생물 식생은 혈류와 함께 몸을 순환하며 뇌에 들어가면 뇌경색을 일으키며 마비, 마비 및 기타 다양한 신경 장애를 동반합니다. 파괴된 판막은 기능을 수행할 수 없으며 곧 번개처럼 빠르게 진행되는 심부전이 발생합니다. II 단계 - 밸브에 고정된 미생물이 장기 및 신체 조직에 대한 장기간의 자가 과민 반응 및 과민성 손상을 일으키는 면역 염증성(과정의 면역 일반화). 이 기간 동안 면역 복합체는 혈액을 순환하고 조직(심장, 신장, 간, 혈관)에 고정됩니다. 면역 및자가 면역 장애는 혈관염 및 내장염 (면역 복합 신염, 심근염, 간염, 모세 혈관염 등)의 발병을 유발합니다. III 기 - 영양 장애 - 병리학 적 과정의 진행과 함께 발생합니다. 여러 기관의 기능이 방해 받고 심장 및 신부전이 발생하여 질병의 진행을 더욱 악화시킵니다. 분류. 현재 IE의 분류 및 명명법은 질병의 임상 형태, 경과 변형, 활동 정도, 발병 단계 및 임상 및 형태학적 형태를 반영하여 사용됩니다(표 6 참조). 표 6 IE의 분류
활성 및 비활성(치유된) IE도 구분됩니다. 다음과 같은 외과 분류도 있습니다. 1) 병변은 판막 소엽으로 제한됩니다. 2) 병변이 판막을 넘어 확장됩니다. 급성 IE(급속 진행, 8-10주에 걸쳐 발생)는 일반적으로 이전에 심장 질환을 앓은 적이 없는 개인에서 드물고 임상적으로 전신 패혈증의 사진으로 나타납니다. 현대 치료 방법으로 아급성으로 번역하는 것이 가능합니다. 아급성 IE(가장 흔함)는 3-4개월 동안 지속되며 적절한 약물 요법으로 관해가 발생할 수 있습니다. 그러나 질병의 재발이 가능합니다. 장기간 IE는 악화 및 완화 기간과 함께 수개월 동안 지속되며 경미한 임상 증상, 사소한 실험실 매개 변수 및 일반적인 장애를 특징으로 합니다. 질병은 일반적으로 치료에 잘 반응합니다. 바람직하지 않은 과정으로 심각한 합병증이 발생하고 환자는 진행성 심부전으로 사망하여 패혈증 중독이 증가합니다. 임상 사진. 감염의 원인 물질에 따라 IE는 갑자기 발생하여 빠르게 진행되거나(황색포도상구균, 장구균) 잠복기 발병(비리단스 연쇄구균)될 수 있습니다. IE의 증상은 증후군의 형태로 나타납니다. 1) 염증성 변화 및 패혈증의 증후군(발열, 오한, 출혈성 발진, 급성기 혈액 변수의 변화: 왼쪽으로 이동하는 백혈구 증가, ESR 증가, C 반응성 단백질의 출현, 피브리노겐 증가, α2-글로불린. 2) 신체의 일반적인 중독 증후군 (쇠약, 발한, 두통, 근육통 및 관절통, 식욕 부진, 황달을 동반한 피부 창백). 3) 판막 손상 증후군(심장 질환의 형성). 4) "실험실" 면역 장애의 증후군(혈액에서 순환하거나 신장, 심근, 혈관에 고정된 면역 복합체의 존재, 고감마글로불린혈증, 류마티스 인자의 출현, 항조직 항체 검출). 5) 혈전색전성 합병증의 증후군(국소성 신염, 심근경색증, 비장, 장, 뇌의 혈전색전증, 하지의 혈관 등). 6) 병변의 전신화 증후군(미만성 사구체신염, 심근염, 간염, 혈관염 등). 이러한 증후군의 중증도는 다릅니다. 그것은 IE의 과정, 병기, 병원체 유형에 따라 다릅니다. 예를 들어, 포도상구균 IE는 과정의 높은 활동, 일반적인 중독의 심각한 증상 및 화농성 합병증의 발병이 특징입니다. 진균성 심내막염은 일반적으로 큰 동맥, 특히 하지의 색전성 폐색을 동반합니다. 질병의 전형적인 모습은 streptococcus viridans에 의해 유발되는 IE의 특징입니다. 질병의 발병은 종종 급성 감염 또는 만성 감염의 악화, 많은 의학적 조작과 관련이 있습니다. 특히 특징은 오한과 발한과 함께 다양한 정도의 체온 상승 (열이 지속되는 상태에서 열이 아닌 상태 또는 정상 온도로)의 조합입니다. 환자는 감염 과정과 중독, 심장 손상의 혈전 색전증 합병증으로 인해 동시에 불만을 나타냅니다. 환자는 장기간 항생제 치료를 받은 병력이 있을 수 있습니다(이는 이전에 치료받은 환자에서 IE가 재발할 때 발생함). 진단. 올바른 진단을 내리는 데 가장 중요한 것은 기존 심장 결함의 청진 패턴 변화를 통해 심장 판막 손상을 감지하는 것입니다. "추가" 소음이 나타납니다. 피부와 점막의 특징적인 병변이 드러납니다: 카페오레 피부색, 출혈, 양성 Hecht(핀치) 및 Konchalovsky-Rumpel-Leede(지혈대) 증상, Osler 결절 - 손바닥 표면에 통증이 있는 충혈성 조밀 결절 손가락 끝 , Lukin-Libman 징후 (Lukin 반점) - 결막의 과도 주름에 출혈이 있습니다. IE에서는 비장종대가 자주 관찰됩니다. 상당한 체중 감소(때로는 15-20kg)가 매우 일반적입니다. 드물게 심낭염(심낭의 섬유소 침착으로 인해 발생하는 희미한 흉막 마찰음)이 발생합니다. 신체 검사를 통해 혈압이 상승하여 미만성 사구체신염이 발생했음을 알 수 있습니다. 때로는 대뇌 혈관의 색전증으로 인해 중추 신경계 기능 장애 (마비, 운동 과다, 병리학 적 반사 등) 징후가 결정됩니다. 이 경우 가장 흔한 진단 오류는 특정 증후군을 독립적인 질병의 징후로 평가하는 것입니다(예: 간 손상의 뚜렷한 징후, 간염 진단 등). 그러나 IE의 진단은 주로 질병의 원인 인자의 조기 발견에 기초합니다. 이를 위해 다음과 같은 실험실 및 도구 연구가 사용됩니다. 1) 양성 혈액 배양을 얻는 것이 IE의 가장 중요한 진단 징후입니다. 이 경우 가장 효과적인 항생제를 선택하기 위한 분석도 필요합니다. 진단을 확인하려면 적어도 2-3개가 필요합니다. 매우 중요한 것은 혈액 샘플링 및 배양 기술, 접종 시간(가급적 발열이 높을 때), 농축 배지의 사용입니다. 2) NBT(nitrobluttetrazolium test) 수행 - 세균 감염을 다른 염증성 질환과 구별할 수 있는 전신 세균 감염 진단. 이 방법은 호중구에 의한 가용성 NBT 염료를 불용성 포르마잔 침전물로 환원시키는 방법을 기반으로 합니다. NBT 양성 세포의 수가 10% 이상이면 검사를 양성으로 간주합니다. 3) 급성기 지표를 감지하기 위한 임상 혈액 검사: ESR이 50 mm/h 이상으로 증가, 백혈구 공식이 왼쪽으로 이동하는 백혈구 증가, 또는 (II 단계에서) 백혈구 감소증 및 저색소성 빈혈을 감지할 수 있습니다. 진단 가치는 귓불에서 채취한 혈액에서 조직구의 검출에 첨부됩니다. 시야에서 6 이상의 내용은 IE에 유리함을 나타낼 수 있습니다. 생화학 적 혈액 검사에서 피브리노겐 α의 함량이 증가함을 보여줍니다.2-글로불린 및 α-글로불린 - 최대 30-40%. 4) 면역학적 변화 확인: 고감마글로불린혈증, 순환하는 면역복합체, 보체역가 감소, 류마티스(항글로불린) 인자의 출현, PHA(phytohemagglutinin) 및 세균 항원에 의한 림프구의 과도한 변형 반응 증가, 항조직 항체 검출 . 5) 사구체 신염이 감지되면 단백뇨, 원통 뇨 및 혈뇨로 나타나는 다양한 기관 및 시스템의 병변을 명확히하기 위해 소변 검사가 수행됩니다. 빌리루빈, 트랜스아미나제 함량의 증가는 간 손상을 나타냅니다. 6) IE의 직접적인 진단 징후(심장 판막에 식물의 존재)는 심장초음파검사로 감지됩니다. 따라서 다양한 증상 중에서 주요 증상과 추가 증상을 구별해야합니다. IE 진단의 주요 기준: 1) 오한과 함께 38 ° C 이상의 온도로 발열; 2) 루킨 반점; 3) 오슬러의 결절; 4) 변하지 않은 판막(일차) 또는 류마티스 및 선천성 심장 결함의 배경에 대한 심내막염. 감염성 심근염; 5) 다발성 동맥 혈전색전증, 출혈을 동반한 진균성 동맥류의 파열; 6) 비장종대; 7) 양성 혈액 배양; 8) 항생제 사용으로 인한 뚜렷한 긍정적 효과. IE 진단을 위한 추가 기준: 1) 38 ° C까지 체온 상승, 오한; 2) 피부의 출혈; 3) 급격한 체중 감소; 4) 손, 발의 작은 관절의 비대칭 관절염; 5) 빈혈; 6) 40mm/h 이상의 ESR; 7) 급격히 긍정적인 SRV; 8) 류마티스 인자의 존재; 9) 25% 이상의 α-글로불린; 10) 면역 글로불린 M, E 및 A의 함량 증가. 차동 진단. 혈전색전증은 IE에서 가장 흔히 관찰되지만 전신 순환 동맥의 색전증의 다른 원인을 배제해서는 안 됩니다. 경벽성 심근경색 및 심장 동맥류, 특발성 Abramov-Fiedler 심근염 및 다양한 기원의 심방세동(주로 류마티스 협착증에서 관찰됨) 왼쪽 방실 구멍의. 류마티스 및 감염성 심내막염은 감별 진단에 가장 중요합니다(표 7). 표 7 류마티스성 심내막염과 장기간 IE에 대한 감별 진단 기준
IE의 특징적인 증상은 비장 비대를 포함합니다. 그러나 아밀로이드증에서는 크고 단단하며 통증이 없는 비장이 나타납니다. 부드럽고 통증이 없으면 패혈성 증식을 나타냅니다. 피막하부에 위치한 비장의 경색으로 통증이 나타납니다. 비장 비대는 우심부전에서 문맥 고혈압의 징후 중 하나일 수 있습니다. 이 경우 복수 및 간 비대와 결합됩니다. 연장된 IE에 따른 간 크기의 증가는 꽤 자주 관찰됩니다. 패혈성 증식은 상대적으로 작은 비대와 부드러운 일관성을 특징으로 합니다. 지방 변성과 극히 드물게 간 경색이 있습니다. 대부분의 경우 간의 증가는 우심부전을 동반한 정맥 울혈과 관련이 있습니다. 복수가 없으면 심장 배당체와 이뇨제로 치료한 후 간 크기가 감소하여 울혈이 소급하여 인식됩니다. 치료. IE의 치료는 세균학적 데이터를 고려하여 가능한 한 조기에 병인성으로 이루어져야 합니다. 항균 약물이 의료 현장에서 널리 사용되기 전에는 대부분의 IE 환자가 감염 및 합병증으로 사망했습니다. 이제 80% 이상이 성공적으로 치료되었습니다. 그러나 거의 20%의 경우 약물 치료가 효과가 없으며 곧 거의 치료가 불가능한 심부전이 발생합니다. 이런 경우에는 보존적 치료와 수술적 치료를 병행하는 것이 좋습니다. 모든 연령대의 IE 치료를 위해 주로 미생물에 살균 효과가 있는 항생제가 사용되며, 바람직하게는 혈액 내 항생제 농도와 이에 대한 병원체의 감수성에 따라 개별화된 용량으로 사용됩니다. 첫 번째 선택 약물은 여전히 페니실린입니다. 독성이 낮아 비교적 높은 용량으로 장기간 사용할 수 있습니다. 일일 복용량 - 최대 20IU를 정맥 및 근육 주사합니다. 그러나 노인 및 노인 환자의 경우 페니실린 및 기타 항생제를 고용량으로 치료하면 심부전의 출현 또는 심화, 심장 통증, 빈맥과 같은 심장 독성 효과가 종종 관찰된다는 사실을 배제해서는 안됩니다. 용량을 줄이거나 약물을 변경하면 이러한 현상이 멈춥니다. 병인이 알려지지 않은 경우 치료는 고용량의 벤질페니실린을 근육 내 또는 정맥 내로 최대 18-000 단위 이상, 스트렙토마이신과의 조합으로 하루 최대 000g/m 또는 아미노글리코사이드(젠타마이신, 토브라마이신 20-000mg 비율)로 시작됩니다. /일)을 사용합니다.kg/일). 효과가 없거나 병원체를 결정한 후 반합성 페니실린이 사용됩니다 (oxacillin, methicillin 또는 ampicillin은 근육 내 최대 000g / day). Cephalosporin은 IE 치료에 사용되는 기본 약물이기도 합니다. 가장 일반적으로 사용되는 약물은 claforan, cefamisin(1-4g/일, 근육 및 정맥 주사), zeporin(6-12g/일) 및 kefzol(최대 4개)입니다. -10g 정맥 내). 등). Fusidin은 좋은 포도상 구균 효과가 있으며 경우에 따라 다른 항생제 (10-16g / day)에 대한 미생물의 내성에 효과적입니다. 항생제 치료는 감염이 완전히 제거될 때까지 1,5-2개월 동안 장기간 처방됩니다. 감염 제거 후 환자의 전반적인 상태가 개선되고 심장 초음파 및 미생물 확인에 따라 식물이 사라집니다. 유기체의 면역 반응성이 감소함에 따라 항균제는 면역 조절제 (티말린, T-액티빈 등)를 사용하여 수동 면역 요법 (예 : 포도상 구균 심내막염 - 항 포도상 구균 혈장 또는 항 포도상 구균 α- 글로불린)과 결합됩니다. 예를 들어, 혈관신생 패혈증의 배경에 대해 발병한 심내막염으로 혈전증을 예방하기 위해 헤파린(20-000 IU 정맥 또는 피하)을 사용하여 조절된 저응고가 생성됩니다. 단백질 분해 효소의 억제를 위해 contrical이 사용됩니다(정맥 내 최대 25-000 IU). 판막 IE가 판막 심장 질환의 형성에 기여하거나 대규모 항생제 치료에도 불구하고 질병의 징후가 사라지지 않으면 외과 적 치료를 수행하는 것이 좋습니다. 외과적 개입을 지지하는 또 다른 주장은 감염에 의해 파괴된 심장 판막 소엽에서 반복되는 색전증입니다. 때로는 감염이 판막 링의 경계를 넘어 농양을 형성하는 동안 외과 적 치료의 징후이기도합니다. 수술의 주요 목표는 환자 자신의 판막을 보존하는 것입니다. 때로는 식생 제거, 판막 파열 봉합 등으로 제한되기도 합니다. 감염의 영향으로 판막이 거의 완전히 파괴되면 기계적, 생물학적 보철물을 사용하여 인공 판막(보철물)으로 교체합니다. 예방. IE 예방은 구강, 편도선, 비인두, 부비동염의 만성 감염 부위를 적시에 위생 처리하고 급성 연쇄상 구균 및 포도상 구균 질환 (협심증 등)에 대한 활성 항균 요법을 사용하는 것으로 구성됩니다. 몸을 굳히는 것이 좋습니다. 판막 심장 질환이 있는 모든 환자와 인공 판막은 중재 전날과 직후에 예방적으로 항생제를 복용해야 하며, 그 후에 감염이 혈류에 들어갈 수 있습니다. 급성 연쇄상 구균, 포도상 구균 감염이 있는 사람의 진료실 관찰이 필요합니다. 강의 6. 호흡기 질환. 기관지 천식 천식에 대한 완전한 정의는 현재까지 존재하지 않지만, 이 질병에 대한 가장 완전한 정의는 1982년 G. B. Fedoseev에 의해 주어졌습니다. 기관지 천식(BA)은 호흡기의 원발성 병변이 있는 독립적이고 만성 재발성 질환입니다. 특정(면역학적) 및(또는) 비특이적, 선천적 또는 후천적 기전으로 인해 기관지 반응성이 변경되고 주요(필수) 임상 징후가 천식 발작 및(또는) 천식 상태인 주요 및 필수 병인 기전 (천식 상태) 기관지 평활근의 경련, 과분비, 기관지 점막의 부종 및 분비 장애로 인한 것. 병인학. 여러 요인의 조합이 천식 발생에 중요한 역할을 합니다. 이와 관련하여 천식에는 아토피 성 (라틴어 아토피아 - "유전성 소인")과 감염성 알레르기의 두 가지 형태가 있습니다. 유전적 소인은 천식의 중증도와 특정 조직적합성 항원(HLA)의 연관성에 기인하며, 질병의 중증도의 증가는 특히 B 항원 보균자에서 흔히 관찰됩니다.35 및 B40. 질병 발병의 내부 요인은 면역, 내분비 계통, 자율 신경계, 기관지 민감도 및 반응성, 점액 섬모 청소율, 폐 혈관 내피, 신속한 반응 계통 (비만 세포 등), 아라키돈산 대사의 생물학적 결함입니다. . 외부 요인은 다음과 같습니다. 1) 감염성 알레르겐(바이러스, 박테리아, 곰팡이, 효모 등); 2) 비감염성 알레르겐(꽃가루, 먼지, 산업, 의약, 식품, 진드기, 곤충 및 동물의 알레르겐); 3) 기계적 및 화학적 자극제(금속, 목재, 규산염, 면 먼지, 산, 알칼리 증기, 흄 등); 4) 기상 및 물리 화학적 요인(대기 온도 및 습도의 변화, 기압의 변동, 지구 자기장, 물리적 노력 등); 5) 스트레스, 신경 정신 효과 및 신체 활동. 감염원은 알레르기 효과뿐만 아니라 비 감염성 (아토피) 알레르기 항원에 대한 신체의 민감도 임계 값을 감소시키고 호흡기 점막의 투과성을 증가시킵니다. 표적 세포(비만 세포, 호염기구, 단핵구 등) 및 효과기 시스템의 반응성 변화를 형성합니다. 병인. 기관지 반응성의 변화는 질병 발병의 중심 연결고리이며 2차 또는 XNUMX차일 수 있습니다. 첫 번째 경우 반응성의 변화는 화학적, 기계적, 물리적 요인 및 감염에 대한 직접적인 노출로 인해 선천적이거나 후천적일 수 있습니다. 기관지 반응성의 이차적 변화는 신체의 면역, 내분비 및 신경계의 반응성 변화의 징후입니다. 따라서 AD의 발병기전을 살펴보면 면역학적 메커니즘과 비면역학적 메커니즘이라는 두 가지 메커니즘 그룹을 구분할 수 있습니다. 대부분의 경우 면역 기전은 질병의 진행 과정에서 지배적입니다. 과민 반응의 유형 I, III 및 IV에 따라 발생하는 호흡기 점막의 면역 적격 시스템 위반, 즉 체액 및 세포 면역의 변화는 기관지 반응성의 변화로 이어집니다. 동시에 분비 IgA가 감소하고 식균 작용 시스템이 파괴되고 림프구의 T-억제 기능이 감소하고 인터페론 생성이 감소하여 궁극적으로 신체의 항바이러스 방어가 감소합니다. I형(아토피, 레기닌 또는 아나필락시스). 외알레르겐 항원(꽃가루, 동물 및 식물 단백질, 박테리아 및 약물)의 섭취에 대한 반응으로, 비만 세포(XNUMX차 효과기 세포)에 고정되어 축적되는 IgE(reagins)의 생산 증가가 발생합니다. 이것은 AD의 면역학적 단계입니다. 그 후 병리 화학적 단계가 진행됩니다 - 혈관 활성, 기관지 경련 및 화학 주성 물질 (히스타민, 세로토닌, 다양한 주화 인자 등)의 방출로 비만 세포의 탈과립. 이들은 호산구, 호중구, 혈소판, 대식세포 단핵구와 같은 혈관 및 표적 세포(XNUMX차 효과기 세포)에 작용하는 XNUMX차 매개체입니다. 후자는 XNUMX차 매개체에 노출되면 XNUMX차 매개체(류코트리엔, 프로스타글란딘, 트롬복산, 혈소판 활성화 인자 및 에이코사노이드 그룹에 속하는 기타 물질)를 분비합니다. 생물학적 활성 물질의 영향으로 병인의 병태 생리 학적 단계가 시작됩니다. 미세 순환계의 투과성이 증가하여 부종, 장액 염증 및 기관지 경련이 발생합니다. 임상 적으로 이것은 기관지 개통의 급성 위반과 천식 발작의 발병으로 나타납니다. 유형 III 반응(면역복합체 유형 또는 Arthus 현상)은 외알레르겐 및 내알레르겐(자가알레르겐, 형성은 감염성 또는 알레르기성 염증 및 다양한 자극제). 반응은 O 및 M 클래스의 면역 글로불린에 속하는 침전 항체의 참여로 과잉 항원 영역에서 발생합니다. 형성된 항원 - 항체 복합체의 손상 효과는 보체 활성화, 리소좀 효소의 방출을 통해 실현됩니다. 기저막 손상, 기관지 평활근 경련, 혈관 확장 및 미세 혈관계의 투과성이 증가합니다. 유형 IV(세포성, 지연형 과민증)는 감작된 림프구가 손상 효과가 있다는 사실이 특징입니다. 이 경우 알레르기 반응의 매개체는 림포카인(대식세포, 상피 세포에 작용), 리소좀 효소 및 활성화된 키닌 시스템입니다. 이러한 물질의 영향으로 부종이 발생하고 점막이 부어 오르고 기관지 경련이 발생하며 점성 기관지 분비물이 과도하게 생성됩니다. 결과는 질식의 공격으로 나타나는 기관지 개통의 심각한 위반입니다. 비면역 기전은 선천적 및 후천적 생물학적 결함의 결과로 기관지 반응성의 주요 변화입니다. 비 면역 학적 메커니즘은 XNUMX 차 또는 XNUMX 차 효과기 세포 또는 기관지 평활근 수용체, 혈관, 기관지 샘 세포에 작용합니다. 이것은 생물학적 활성 물질(히스타민, 류코트리엔 등)의 과도한 생산을 수반하는 표적 세포, 그리고 무엇보다 비만 세포의 반응성을 변화시킵니다. 방출에 대한 반응으로 기관지 경련, 점막의 부종, 기관지 땀샘의 과잉 및 판별이 발생합니다. 이 모든 것이 기관지의 개통성을 극적으로 변화시키고 천식 발작을 일으킵니다. 기관지 저항은 반사적으로 조건부 및 무조건적으로 바뀔 수 있습니다. 예를 들어, 차가운 공기에 대한 노출, 자극적인 가스 및 먼지의 흡입, 신체 활동으로 인해 발생하는 폐색은 미주 반사를 통한 기관지 경련으로 인해 발생합니다. 기관지 경련의 원인은 또한 미주신경 기관지 수축 반사의 효과기 영역에 대한 손상 또는 β-아드레날린성 수용체의 차단일 수 있습니다. 최근에 그들은 글루코 코르티코이드 부전 및 이분비 장애의 기관지 개통을 위반하는 병인의 특별한 역할에 대해 이야기합니다. 글루코코르티코스테로이드가 부족하면 비만세포의 과민반응이 발생하고 카테콜아민 합성이 감소하며 프로스타글란딘 F가 활성화됩니다.2a, 면역 적격 시스템의 위반 (여기서 우리는 AD의 발병 기전과 면역 학적 및 비 면역 학적 메커니즘에 대한 복잡한 참여에 대해 이야기합니다). 고에스트로겐혈증 및 저프로게스테론혈증은 α- 및 β-아드레날린성 수용체에 작용하여 전자의 활성을 증가시키고 후자의 활성을 감소시킨다. 분류. 천식의 병인에서 하나 또는 다른 메커니즘의 우세로 인해 우리는 천식의 다양한 병인적 특징을 확인할 수 있습니다. 현재 G. B. Fedoseev(1982)가 제안한 분류가 사용됩니다. AD 발달의 단계. I - 천식 전(발달을 위협하는 상태: 급성 및 만성 기관지염, 혈관 운동성 비염, 두드러기와 함께 기관지 경련 요소가 있는 급성 및 만성 폐렴). II - 임상적으로 형성된 BA(첫 발작 후 또는 천식 상태의 즉시 발병으로 간주됨). 학사 양식: 1) 면역학적; 2) 비 면역학적. AD의 병원성 기전(임상 및 병원성 변이체): 1) 아토피; 2) 감염 의존성; 3) 자가면역; 4) 부조화; 5) 신경심리적 불균형; 6) 아드레날린성 불균형; 7) 콜린성 불균형; 8) 일차적으로 변경된 기관지 반응성. 한 환자에서 여러 임상 및 병인 변이의 조합이 가능합니다. 이러한 상황에서는 검사 시 적절한 치료에 중요한 이 환자의 주요 변이를 강조 표시해야 합니다. BA의 긴 과정에서 병인 기전의 변화가 가능합니다. BA의 심각도: 1) 경미한 경과 (악화는 드물며 2 년에 3-XNUMX 번, 다양한 기관지 확장제를 내부에 복용하여 단기 천식 발작을 멈춤); 2) 중등도(3년에 4-XNUMX회 더 빈번한 악화, 천식 발작이 더 심하고 약물 주사로 중단됨); 3) 심한 과정 (빈번하고 장기간의 악화, 심한 발작, 종종 천식 상태로 변하는 특징). 과정의 심각도에 따른 BA의 구분은 조건부입니다. 따라서 가벼운 BA 과정으로 환자는 갑자기 발병한 천식 상태로 사망할 수 있습니다. BA 과정의 단계: 1) 악화(천식 또는 천식 상태의 재발성 발작의 존재); 2) 악화 완화(공격이 더 드물어지고 경미해지며, 질병의 신체적 및 기능적 징후가 악화 단계보다 덜 두드러짐); 3) 관해(BA의 전형적인 징후가 사라짐: 천식 발작이 발생하지 않음, 기관지 개통이 완전히 또는 부분적으로 회복됨). 합병증 : 1) 폐: 폐기종, 폐기능부전, 무기폐, 기흉, 천식 상태 등; 2) 폐외: 폐성심(우심부전의 발달로 보상 및 비보상), 심근 이영양증 등 임상 사진. 천식의 가장 특징적인 징후는 질식(주로 호기 중 호흡 곤란), 숨가쁨 및 다양한 유형의 기침(건조, 발작 또는 점성 가래 방출과 함께)에 대한 불만입니다. 기관지폐 감염이 발생하면 체온이 상승합니다. 그로 인한 비강 호흡 곤란은 일반적으로 천식 전 단계에 발생하는 알레르기성 비부비동병증(혈관운동성 비염, 용종증)의 징후입니다. 이력 데이터는 발작의 발병과 특정 알레르겐 및 기타 요인에 대한 노출 사이의 연관성을 확립하는 데 도움이 됩니다. 가장 흔한 것은 호흡기 감염, 특히 질병의 악화입니다. 기억상실증을 통해 육체적 노력의 영향(빠르게 걷기, 웃음 등), 기상 요인의 변화(추위, 다습 등), 이질성 장애, 천식 발생에 대한 전문적 요인에 대해 배웁니다. 공격. 알레르기 병력에 대한 연구는 BA의 아토피 변이체 진단에 기여합니다. 이러한 경우 질병의 악화는 비염, 결막염을 동반하는 계절적(봄과 여름에 더 자주)입니다. 그러한 환자는 두드러기, Quincke 부종을 가지고 있습니다. 식품 불내증, 많은 의약 물질이 감지됩니다. 알레르기 질환에 대한 유전 적 소인이 있습니다. 기억상실증의 데이터는 종종 소위 아스피린 천식의 존재를 입증합니다. 이 경우 알레르기 질환의 유전적 형태는 없습니다. 이러한 환자들은 비강 호흡 장애(용종성 성장)에 대해 우려하고 있으며, 가장 특징적인 증상은 천식 발작을 일으키는 비스테로이드성 항염증제(아세틸살리실산, 인도메타신 등)에 대한 과민증입니다. 이 경우 이미 AD의 프로스타글란딘 메커니즘을 가정하는 것이 가능합니다. 과거 천식 상태의 발달에 대한 데이터는 질병 경과의 심각성을 나타내며 코르티코스테로이드 요법의 필요성을 나타냅니다. 진단. 가장 중요한 것은 알레르기의 폐외 증상, 기관지 폐쇄 징후, 천식 합병증 및 기관지 경련 발작을 동반하는 기타 질병을 식별하는 것입니다. 피부를 검사할 때 BA의 면역학적 변이를 나타내는 두드러기, 구진 홍반성 발진과 같은 알레르기 증상이 감지될 수 있습니다. 천식과 습진, 신경 피부염, 건선의 조합은 심각한 천식에 걸리기 쉽습니다. 비강 호흡의 위반을 식별하는 것이 종종 가능합니다. 비염과 폴립은 천식 전으로 간주됩니다. 부비동염 및 기타 부비동염은 질식을 유발할 수 있습니다. 종종 기저의 만성 기관지염으로 인한 폐의 신체 검사는 만성 호흡 부전 및 폐성 폐의 발병으로 이어지는 폐기종의 징후를 나타낼 수 있습니다. 기관지 폐쇄의 청진 징후가 감지됩니다. 호흡의 변화(긴 호기, 건조, 대부분 쌕쌕거림, 쌕쌕거림), 강제 호기, 이는 잠복성 기관지 경련(건조한 천명의 출현 또는 증가)을 나타냅니다. 폐의 청진은 환자가 누워 있는 위치에서 수행해야 합니다. "미주신경" 메커니즘에 따라 건조 랄의 수가 증가합니다. 특정 지역에서 지속적으로 들을 때 축축한("딱딱") 미세한 버블링 소리는 진행성 폐렴을 나타낼 수 있습니다. 환자의 객관적인 검사는 얼굴 피부의 "나비", 간 및 비장의 증가와 함께 림프절 병증, 지속적인 혈압 상승, 지속적인 발열 등의 다른 질병의 증상을 나타냅니다. 기관지 경련의 공격이 발생하며 질식으로 나타납니다(전신성 홍반성 루푸스, 결절성 동맥 주위염). 그러면 알츠하이머병 진단이 거의 불가능해집니다. Spirography는 폐쇄성 기관지 폐쇄의 특징적인 징후를 나타냅니다. 첫 번째 1초 동안 강제 호기량의 감소(FEVXNUMX), Tiffno 계수(FEV)의 감소1 백분율로 VC에) 및 FEV의 백분율1 FZhEL에. BA가 악화되는 동안 잔여 폐 용적(RLV)과 기능적 잔여 용량(FOC)이 초기 수준을 100% 이상 초과합니다. spirogram을 분석 할 때 기관지 운동 이상증의 징후가 발견되어 spirogram의 내림차순 색상 (Kolbet-Wyss 증상)의 상부에 노치가 존재하여 기관지 개통에 기여합니다. Pneumotachometry는 기관지 폐쇄의 특징인 호기력보다 흡기력이 우세함을 보여줍니다. 유량 곡선의 구성을 통한 기압 조영술에 따르면 기관지 개통의 위반은 대, 중 및 소 기관지 수준에서 별도로 진단됩니다. 신체 활동, 찬 공기 흡입, 자극성 가스 및 아세틸콜린에 대한 반응으로 spirography, pneumotachometry 및 pneumotachography를 사용하여 기록된 증가된 기관지 저항의 출현은 변경된 기관지 반응성을 나타냅니다. 알레르기 검사는 다양한 비 전염성 및 전염성 알레르겐 세트를 사용하여 수행되며 질병 악화 이외의 경우에만 수행됩니다. 알레르겐의 유발 효과를 평가하기 위해 피부 알레르기 테스트(알레르겐을 적용하는 도포, 흉터화 및 피내 방법)가 수행되며, 알레르겐은 눈의 결막, 비점막에 적용될 수 있습니다. 가장 신뢰할 수있는 것은 천식의 특정 진단입니다. 흡입 도발 테스트의 도움으로 특정 기관지 과민 반응을 식별합니다. 그러나 이 투여 경로가 심각한 천식 발작 또는 천식 상태의 발병을 유발할 수 있다는 사실을 간과해서는 안됩니다. 예를 들어 알츠하이머병의 특정 진단을 위해 알레르기 검사를 수행할 수 없는 경우 방사성 면역 흡착 검사도 사용되어 IgE 항체를 정량화할 수 있습니다. 실험실 연구는 제안된 진단을 확인하고 질병의 진행 상황과 치료의 효과를 평가하는 데 도움이 됩니다. AD의 주요 진단 기준은 가래에 호산구가 나타나는 것이지만 이것은 비특이적 징후이며 신체의 일반적인 알레르기 반응의 징후로 작용할 수 있습니다. 또한 진단의 중요성은 객담에서 Kurshman 나선 및 Charcot-Leiden 결정의 검출입니다. 실험실 연구는 활성 염증 과정의 존재와 급성기 지표의 증가 측면에서 그 심각성의 정도를 증명합니다. 천식 악화 및 천식 상태의 경우 호흡 부전이 증가함에 따라 산-염기 상태 및 혈액 가스 조성을 연구하는 것이 중요합니다. X 선 검사는 감염의 초점 (부비동, 치아, 담낭)과 급성 (폐렴)의 존재 또는 폐, 폐기종 및 폐렴의 만성 염증 과정의 악화를 진단합니다. ECG 데이터는 보상된 폐성 심장의 발달 징후를 증명합니다 - 오른쪽 심장의 비대. 차동 진단. BA는 심장 천식과 구별됩니다(표 8 참조). 표 8 AD의 감별 진단
감염성 알레르기성 천식과 아토피성 천식을 구별하는 것도 필요하다(표 9 참조). 표 9 감염성 알레르기 및 아토피성 천식
치료. 천식 치료에서는 단계적 접근 방식이 권장되는데, 이는 동일한 환자와 사람에 따라 진행 과정의 심각도가 다양하기 때문에 설명됩니다. 1단계는 가장 가벼운 천식이고, 4단계는 가장 심한 천식입니다. 1단계: 천식 증상이 유발 요인(예: 꽃가루 또는 동물의 털)에 노출되거나 운동으로 인해 나타나는 경미한 간헐적 경과입니다. 이러한 환자의 치료에 항염증제를 장기간 사용하는 것은 표시되지 않습니다. 필요한 경우 예방 약물로 치료함(흡입 β2작용제, 크로모글리케이트, 네도크로밀 또는 항콜린제). 때때로 더 심각하고 장기간의 악화에는 단기간의 경구 코르티코스테로이드가 필요합니다. 천식이 더 빈번한 증상으로 나타나고 기관지 확장제의 필요성이 증가하면 다음 단계로 넘어갈 필요가 있습니다. 2단계. 약간 지속되는 과정. 200차 요법에는 항염증제, 흡입 코르티코스테로이드, 나트륨 크로모글리케이트 또는 네도크로밀 나트륨이 포함됩니다. 코르티코스테로이드의 복용량은 하루 500-XNUMX마이크로그램의 베클로메타손 디프로피오네이트 또는 부데소니드입니다. 대증 치료를 위해 흡입 β2- 작용제, 그러나 하루에 3-4 번 이상. 더 심각하고 장기적인 악화의 경우 짧은 과정의 경구 코르티코스테로이드가 제공됩니다. 흡입용 코르티코스테로이드의 초기 용량에도 불구하고 증상이 지속되면 베클로메타손 디프로피오네이트의 용량을 750일 800-500마이크로그램으로 증량해야 합니다. 그러나, 특히 천식의 야간 발작을 조절하기 위해 흡입 호르몬의 용량을 늘리는 대신 야간에 복용하는 지속성 기관지 확장제를 추가하는 것이 좋습니다(흡입 코르티코스테로이드 용량 XNUMXmcg 이상). 3단계는 중등도의 BA가 특징입니다. 이러한 환자는 예방적 항염증제를 매일 섭취해야 합니다. 흡입용 코르티코스테로이드의 용량은 지속성 기관지 확장제와 함께 800-2000mcg입니다. 지속성 오필린 (5-15 μg / ml 이하의 농도를 지속적으로 모니터링), 경구 및 흡입 β를 사용할 수 있습니다.2장기간 작용하는 작용제. 증상적으로 β를 지정2- 속효성 작용제 또는 대체 약물(2단계). 4단계. 완전히 조절되지 않는 심한 천식. 이 경우 치료의 목표는 최상의 결과를 얻는 것입니다. 800차 치료에는 고용량 흡입 코르티코스테로이드(하루 2000~XNUMX마이크로그램의 베클로메타손 디프로피오네이트)와 지속성 기관지 확장제가 포함됩니다. 필요한 경우 흡입 β를 사용하여 증상을 완화합니다.2-속효성 작용제(하루에 3-4회 이하). 더 심한 악화는 최소 복용량 또는 격일로 처방되는 경구 코르티코스테로이드 치료 과정이 필요할 수 있습니다. 부작용 발생을 방지하기 위해 스페이서를 통해 고용량의 흡입 코르티코스테로이드를 투여합니다. 5단계는 보조 약물을 줄이는 것입니다. 이는 천식이 최소 3개월 동안 조절되는 경우 가능하며, 이는 부작용의 위험을 줄이고 계획된 치료에 대한 환자의 감수성을 높이는 데 도움이 됩니다. 치료의 "감소"는 마지막 복용량 또는 추가 약물을 점진적으로 감소(취소)하여 증상, 임상 증상 및 호흡기 기능 지표의 지속적인 통제하에 수행됩니다. 공격 중지. 경미한 발작은 단기 작용 기관지 확장제로 집에서 치료할 수 있습니다. 증상이 완전히 사라질 때까지 치료를 진행합니다. 중등도 및 중증 발작에는 적절한 용량의 단기 작용 기관지 확장제(흡입 베타)가 필요할 뿐만 아니라2-속효성 작용제) 뿐만 아니라 전신 코르티코스테로이드의 임명. 환자에게 저산소혈증이 있으면 산소를 투여해야 합니다. 의료 센터나 병원에서 천식 발작 치료를 위해 고용량의 흡입 β2분무기를 통해 작용제. 스페이서를 통한 정량 에어로졸 흡입기의 사용은 매우 효과적입니다. 바람직하게는, 코르티코스테로이드는 정맥내가 아닌 경구로 투여된다. 테오필린 또는 아미노필린을 고용량 β와 함께 사용하는 경우2-작용제 추가 기관지 확장 효과는 제공되지 않으나 부작용의 위험이 증가합니다. 테오필린은 β가 없을 때만 사용할 수 있습니다.2-그러나 agonists는 6 mg/kg aminophylline(또는 5 mg/kg theophylline)의 속도로 0,5시간 동안 시간당 1,0-24 mg/kg의 일정한 용량으로 정맥내 투여할 수 있습니다.2속효성 작용제도 에피네프린을 사용할 수 있지만 사용 시 심각한 부작용이 발생할 수 있습니다. 흡입 점액 용해제, 진정제 및 항히스타민 제, 황산 마그네슘, 흉부 물리 치료, 성인 및 나이든 어린이를위한 다량의 수분 공급은 기침 증가를 피하기 위해 천식 발작 치료에 권장되지 않습니다. 예방. 천식의 일차 예방에는 천식 전 상태의 환자 치료, 천식 발생에 위협이 되는 가족력이 있는 실질적으로 건강한 개인의 생물학적 결함 식별, 잠재적으로 위험한 알레르겐, 자극제 및 기타 요인의 제거가 포함됩니다. 질병의 발병으로 이어질 수 있는 환자의 환경. 천식 전 상태의 환자를 치료할 때는 감염병소 소독, 알레르기성 비염 치료, 침과 심리치료, 운동치료, 압력요법, 스파 치료 등 다양한 비약물 치료 방법을 적용하는 것이 필요하다. 특정 및 비특이적 과민 반응을 수행하는 것이 표시됩니다. 강의 7. 호흡기 질환. 만성 기관지염 만성 폐쇄성 기관지염은 다양한 약제의 기관지에 대한 장기간의 자극 효과에 의해 유발되는 기관지의 확산성 비알레르기성 염증성 병변으로, 진행성 경과를 가지며 폐쇄성 폐환기, 점액 형성 및 기관지 배액 기능을 특징으로 한다. 기침, 가래 및 호흡 곤란으로 나타나는 나무. WHO 정의에 따르면 환자가 연속 3년 이상 연속 2개월 이상 대부분의 날에 가래를 토하면 만성 기관지염(CB)으로 간주됩니다. 만성 기관지염은 원발성과 속발성으로 나뉩니다. 원발성 만성 기관지염은 기관지의 확산 병변이있는 다른 기관지 폐 과정 또는 다른 기관 및 시스템의 손상과 관련이없는 독립적 인 질병입니다. 이차 CB는 폐 (결핵, 기관지 확장증 등) 및 폐외 (요독증, 울혈 성 심부전 등)과 같은 다른 질병의 배경에 대해 발생합니다. 대부분의 경우 본질적으로 지역적입니다(분할). 기본 HB를 고려하십시오. 병인학. 외인성 요인(담배 연기, 대기 오염, 불리한 직업 조건, 기후 및 감염 요인)과 내인성 요인(비인두 병리, 코를 통한 호흡 장애, 반복되는 급성 호흡기 질환, 급성 기관지염 및 상부 호흡기의 국소 감염) CB 경로, 유전적 소인, 대사 장애(비만)의 발달에 역할을 합니다. 병인. 외인성 요인과 기관지 나무의 내인성 요인의 참여로 점막과 점막하층의 구조적, 기능적 특성이 변화하고 점막의 염증이 발생하며 기관지의 개통성 및 배액 기능이 중단됩니다. 점막과 점막하층의 구조적 및 기능적 변화는 잔 세포, 기관지 땀샘, 두껍고 점성인 점액의 과분비로 인해 점막 섬모 수송 시스템의 붕괴를 초래하는 증식 및 과기능으로 표현됩니다. 분비되는 IgA-리소자임과 락토페린의 생성량이 감소합니다. 점막의 부종이 발생하고 상피의 위축과 화생이 발생합니다. 점막의 염증은 감염(바이러스 및 박테리아)과 함께 다양한 자극제에 의해 발생합니다. 공기 중에 포함된 화학물질(오염물질)은 호흡기에 손상을 주어 점막의 부종이 발생하고 섬모상피의 활동이 억제된다. 이것은 대피를 위반하고 기관지 점막의 장벽 기능을 감소시킵니다. Catarrhal 내용은 catarrhal-purulent로 대체 된 다음 화농성입니다. 기관지 나무의 말단 부분으로의 염증 과정의 확산은 계면 활성제의 생성을 방해하고 이물질을 포식하는 폐포 대 식세포의 활동을 감소시킵니다. 염증의 경우 발생하는 기관지 경련이 발음되면 기관지 경련 (비 알레르기 성) 성분이 발생합니다. 염증이 악화되는 동안 관련 감염은 천식(알레르기) 성분의 발달에 기여하여 이러한 CB를 천식 전으로 돌릴 수 있습니다. 폐쇄 증후군은 여러 요인의 조합으로 인해 발생합니다. 1) 외인성 요인의 자극 효과와 점막의 염증 변화로 인한 기관지 평활근 경련; 2) 점액의 과분비, 유변학적 특성의 변화, 점성 비밀로 점액 섬모 수송 및 기관지 막힘으로 이어진다. 3) 원통형에서 중층 편평 상피 화생 및 그 증식; 4) 계면 활성제 생산 위반; 5) 염증성 부종 및 점막 침윤; 6) 작은 기관지의 붕괴 및 세기관지의 소멸; 7) 점막의 알레르기 변화. 대구경 기관지가 과정에 관여하는 경우(근위 기관지염), 기관지 폐쇄가 나타나지 않습니다. 그러나 중소 기관지가 손상된 경우 기관지 개통에 대한 명백한 위반이 발생합니다. 그러나 기침 수용체가 없는 작은 기관지의 고립된 병변(원위 기관지염)의 경우 호흡 곤란이 기관지염 발병의 유일한 증거일 수 있으며 더 큰 기관지가 이 과정에 관여할 때 기침이 나타납니다. 점막의 다양한 변화 비율은 특정 임상 형태의 형성을 유발합니다. 1) 카타르 비폐쇄성 기관지염의 경우 점막의 구조적 및 기능적 특성의 표면적 변화가 우세합니다. 2) 점액 화농성 (화농성) 기관지염의 경우 감염성 염증 과정이 우세합니다. 그러나 감염의 추가로 인한 장기 카타르 기관지염이 점액 화농성 등이 될 수 있는 상황도 가능합니다. 만성 기관지염의 모든 임상 형태의 비폐쇄성 변형에서 환기 장애가 약간 뚜렷합니다. 3) 폐쇄성 장애는 초기에는 질병 악화의 배경에만 나타나며 기관지, 과잉 및 이상운동증, 기관지경련(폐쇄의 가역적 구성요소)의 염증성 변화에 의해 유발되지만 폐쇄성 증후군이 성장하는 동안 지속적으로 지속됨 느리게. 폐쇄성 만성 기관지염에서는 점막과 점막하층이 두꺼워지고 부종과 과분비가 우세하며 지속적인 환기 장애도 특징적입니다. 작은 기관지의 발달 된 폐쇄는 폐기종으로 이어집니다. 그 과정에서 HB는 특정 진화를 겪습니다. 폐기종 및 폐렴의 발병으로 인해 폐의 고르지 않은 환기가 관찰되고 과 환기 및 저 환기 영역이 형성됩니다. 국소 염증 변화와 함께 이는 가스 교환 장애, 호흡 부전, 동맥 저산소증 및 폐 고혈압으로 이어지며 생명을 위협하는 주요 상태인 우심실 부전이 발생합니다. 분류. 현재 일반적으로 인정되는 CB 분류는 없습니다. CB를 폐쇄성 변종과 비폐쇄성 변종으로 나누는 것이 중요하며, 각각 카타르성(점액), 카타르-화농성 또는 화농성 염증 과정이 발생할 수 있습니다. 분류에는 출혈성 및 섬유소성 CB와 같은 희귀 형태도 포함됩니다. 기관지 손상의 수준에 따라 구별됩니다. 주요 병변, 큰 기관지 (근위 기관지염) 및 작은 기관지의 주요 병변 (원위 기관지염) (N. R. Paleev, 1985). 임상 사진. CB의 주요 증상은 기침, 가래 생성, 호흡 곤란입니다. 질병이 악화되거나 폐부전 및 기타 합병증이 발생하는 저산소증으로 인해 일반적인 증상이 확인됩니다 (발한, 약화, 체온 상승, 피로 등). 기침은 질병의 가장 전형적인 증상입니다. 가래의 성격과 일관성에 따라 질병 경과의 변형을 가정할 수 있습니다. 카타르성 기관지염의 비폐쇄성 버전에서는 기침에 소량의 점액성 묽은 가래가 동반됩니다(보통 아침, 운동 후 또는 호흡 증가로 인해). 질병이 시작될 때 기침은 환자를 괴롭히지 않습니다. 발작성 기침의 출현은 기관지 폐쇄가 발생했음을 나타냅니다. 기침은 짖는 소리를 내며 기관과 큰 기관지의 호기 허탈이 뚜렷이 나타나는 발작성 성격을 갖습니다. 화농성 및 점액 화농성 기관지염으로 환자는 가래를 기침하는 것에 대해 더 걱정합니다. 질병이 악화되면 가래가 화농성 성격을 띠고 그 양이 증가하며 때로는 가래가 어렵게 배설됩니다 (악화 중 기관지 폐쇄로 인해). 기관지염의 폐쇄성 변형에서 기침은 비생산적이며 소량의 가래와 함께 숨가쁨을 동반합니다. 호흡곤란은 모든 만성 기관지염 환자에서 다양한 시기에 발생합니다. 처음에 상당한 신체 활동을 하는 "장기 기침" 환자에서 숨가쁨이 나타나는 것은 기관지 폐쇄가 추가되었음을 나타냅니다. 질병이 진행됨에 따라 숨가쁨이 더욱 뚜렷해지고 일정해집니다. 즉, 호흡(폐) 부전이 발생합니다. 비폐쇄성 변형에서 CB는 천천히 진행되며 호흡곤란은 일반적으로 질병 발병 후 20-30년에 나타납니다. 이러한 환자는 질병의 발병을 거의 수정하지 않고 합병증이나 빈번한 악화의 출현만을 나타냅니다. 감기에 대한 과민증의 병력이 있으며 대부분의 환자는 장기간 흡연을 보고합니다. 많은 환자에서 이 질병은 직장에서의 직업적 위험과 관련이 있습니다. 기침 이력을 분석할 때 환자가 동일한 증상을 동반하는 다른 기관지 폐 질환(결핵, 종양, 기관지 확장증, 진폐증, 결합 조직의 전신 질환 등)이 없는지 확인해야 합니다. 때때로 병력은 기관지 점막의 약한 취약성으로 인한 객혈을 나타냅니다. 재발성 객혈은 출혈성 형태의 기관지염을 나타냅니다. 또한 만성 기관지염의 객혈은 폐암이나 기관지확장증의 첫 번째 증상일 수 있습니다. 진단. 청진을 통해 심한 호흡(폐기종이 발생하면 약해질 수 있음)과 산발적인 마른 천명음이 드러납니다. 그 음색은 영향을 받은 기관지의 구경에 따라 다릅니다(천명음, 호기 시 잘 들리는 것은 작은 기관지 손상의 특징임) ). 청진 데이터의 변화는 관해 상태의 만성 비폐쇄성 기관지염에서 최소화되고 과정이 악화될 때 가장 두드러집니다(좋은 기침과 가래 생성 후에 사라질 수 있는 다양한 구경의 습한 소리). 폐쇄성 기관지염의 악화로 호흡 곤란이 증가하고 호흡 부전 현상이 증가합니다. 화농성 점성 비밀은 기관지의 개통을 더욱 복잡하게 만듭니다. 기관지염의 카타르 및 점액 화농성 형태와 악화 기간 또는 진행 과정에 합류하는 폐쇄성 구성 요소는 기관지염의 진행을 상당히 악화시킵니다. 기관지 폐쇄의 징후: 침착하고 특히 강제 호흡으로 호기 단계의 연장; 호기 시 천명음(강제 호흡과 앙와위에서 더 잘 청진됨); 폐쇄성 폐기종의 증상. 만성 기관지염의 고급 사례와 합병증이 추가되면 폐 폐기종의 징후, 호흡기 및 심장 (우심실) 기능 부전 - 대상이없는 폐 심장이 나타납니다 : 말단 청색증, 다리와 발의 부종 또는 부종, 손톱의 변화 시계 모양의 안경 및 손과 발의 말단 지골 - 나지만 형태로, 자궁 경부 정맥의 부종, 우심실로 인한 상복부 맥동, II 늑간 공간의 II 음색 악센트 흉골의 왼쪽, 간 확대. 기관지 천식과 유사한 경우 질병의 그림과 천식성(알레르기성) 성분의 추가에 영향을 줍니다. 실험실 지표와 도구 지표는 공정의 단계에 따라 의미가 다릅니다. 질병의 초기 또는 관해기에는 변화가 없을 수 있습니다. 그러나 이러한 지표는 염증 과정의 활동을 식별하는 데 매우 중요합니다. 질병의 임상 형태에 대한 설명; 합병증 식별; 유사한 임상 증상을 가진 질병과의 감별 진단. 만성 기관지염이 있는 모든 환자에서 흉부 엑스레이 검사가 수행되지만 일반적으로 일반 방사선 사진에서는 폐에 변화가 없습니다. 폐렴의 발병으로 인해 폐 패턴의 메쉬 변형이 있을 수 있습니다. 오랜 과정을 거치면 폐기종의 징후가 드러납니다. 폐 심장의 발달과 함께 폐동맥 트렁크의 불룩함이 심장 그림자의 왼쪽 윤곽에 나타나고 기저 동맥이 확장 된 다음 원뿔 모양의 협착 및 직경 감소가 뒤 따릅니다. 주변 가지. X선 검사는 합병증(급성폐렴, 기관지확장증)의 진단과 유사한 증상을 보이는 질환의 감별진단에 중요한 역할을 한다. 기관지조영술은 기관지확장증 진단에만 사용됩니다. 기관지 내시경 검사는 만성 기관지염의 진단과 유사한 임상 양상을 나타내는 질병과의 감별에 매우 중요합니다. 염증 과정의 존재를 확인합니다. 염증의 특성을 명확히 합니다(출혈성 또는 섬유소성 기관지염의 진단은 이 연구 후에만 이루어집니다). 기관지 나무의 기능 장애를 나타냅니다 (호기 붕괴를 식별하는 것이 특히 중요합니다 - 기관 및 큰 기관지의 운동 이상증). 기관지 나무의 유기 병변을 식별하는 데 도움이 됩니다. 또한 기관지경 검사를 통해 미생물, 기생충 및 세포 학적 연구를 위해 기관지 또는 세척액의 내용물을 얻을 수 있습니다. 외호흡의 기능에 대한 연구는 폐환기의 제한적 및 폐쇄성 장애를 식별하기 위해 수행됩니다. spirogram에 따르면 Tiffno 지수가 계산됩니다 (1 초의 강제 호기량의 비율 - FEV1 폐의 필수 용량 - VC(백분율) 및 공기 속도 지표 - PSV(폐의 최대 환기 비율 - MVL 대 VC). 폐쇄 증후군이 발생함에 따라 외호흡의 절대 속도 지표(MVL 및 FEV)가 감소합니다.1), VC 감소 정도 초과; Tiffno 지수가 감소하고 호기 시 기관지 저항이 증가합니다. pneumotachometry에 따르면 호기력보다 흡기력이 우세한 것은 기관지 폐쇄의 초기 징후로 나타납니다. 특별한 pneumotachographs의 도움으로 기관지 나무의 다양한 수준에서 기관지 개통의 위반을 식별하여 "유량 - 부피"곡선을 얻을 수 있습니다. 주변 장애물은 낮은 볼륨 영역에서 유량 곡선의 상당한 감소가 특징입니다. 기관지 저항과 폐 용적에 대한 공동 평가도 폐쇄 수준을 결정하는 데 도움이 됩니다. 큰 기관지 수준의 폐색의 경우 폐의 잔류 용적 (RLV)이 증가하고 총 폐 용적 (TLC)이 증가하지 않습니다. 말초 폐쇄로 인해 TRL이 더 크게 증가하고 TRL이 증가합니다. 기관지 폐쇄의 전체 비율에서 기관지 경련의 비율을 확인하기 위해 일련의 약리학적 테스트 후에 환기 및 호흡 역학을 연구합니다. 기관지 확장제 에어로졸을 흡입한 후, 기도 폐쇄의 경련 요소가 있는 경우 환기 성능이 향상됩니다. 방사성 동위 원소 133Xe를 사용한 방사선 폐촬영은 작은 기관지의 폐쇄와 관련된 고르지 않은 환기를 감지하기 위해 수행됩니다. 이것은 이러한 유형의 기관지 폐쇄의 초기 진단 징후입니다. 폐고혈압과 함께 발생하는 우심실과 우심방의 비대를 감지하기 위해서는 심전도 검사가 필요합니다. QRS 축이 오른쪽으로 뚜렷하게 편차가 있고 전환 영역이 왼쪽으로 이동(V1-V4에서 R / S < 6), S형 ECG가 감지됩니다. 리드 VF, III, II의 높은 날카로운 P파. 임상 혈액 검사는 심각한 폐 기능 부전의 발병과 함께 만성 저산소증으로 인한 이차적 적혈구증가증을 나타냅니다. "급성기"지표는 적당히 표현됩니다. ESR은 정상이거나 적당히 증가하고 백혈구 증가는 작으며 백혈구 공식이 왼쪽으로 이동합니다. 알레르기 발현의 증거로 호산구 증가가 가능합니다. 가래와 기관지 내용물에 대한 연구는 염증의 중증도를 확인하는 데 도움이 됩니다. 심한 염증으로 내용물은 화농성 또는 화농성 점액이며 많은 호중구와 단일 대 식세포를 포함하며 섬모 및 편평 상피의 영양 장애로 변경된 세포는 잘 표현되지 않습니다. 중등도 염증의 경우 내용물은 점액 화농성 물질에 가깝습니다. 호중구의 수가 감소하고 대식세포, 점액 및 기관지 상피 세포의 수가 증가합니다. 가벼운 염증으로 기관지 내용물은 점액이며 상피와 기관지의 박리 세포가 우세합니다. 대식세포와 호중구는 거의 없습니다. 객담과 기관지 내용물의 미생물학적 검사는 만성 기관지염 악화의 원인과 항생제 치료의 선택을 확인하는 데 중요합니다. 차동 진단. 표 10 CB에 대한 감별 진단 기준
치료. 질병의 악화 및 완화 기간 동안 다른 일련의 조치가 포함됩니다. 만성 질환이 악화되는 동안에는 병인성 및 병원성이라는 두 가지 치료 방향이 구별됩니다. Etiotropic 치료는 기관지의 염증 과정을 제거하는 것을 목표로합니다 : 항생제, sulfanilamide 약물, 방부제, 피톤치드 등을 사용한 치료가 표시됩니다. 치료는 페니실린 계열의 항생제 (페니실린, 암피실린) 또는 세팔로 스포린 그룹 (cefamesin)으로 시작됩니다. , tseporin), 효과가 없으면 그룹의 항생제가 예비로 사용됩니다 (gentamicin 등). 가장 바람직한 투여 경로는 기관내(에어로졸 또는 기관지경을 통한 후두 주사기로 채우기)입니다. 병원성 치료는 폐 환기 개선을 목표로합니다. 기관지 개통성 회복; 폐고혈압과 우심실부전의 조절. 기관지에서 염증 과정을 제거하는 것 외에도 폐 환기의 회복은 산소 요법과 운동 요법으로 촉진됩니다. 만성 기관지염 치료에서 가장 중요한 것은 기관지 개통의 회복이며 배수를 개선하고 기관지 경련을 제거함으로써 달성됩니다. 기관지 배수를 개선하기 위해 거담제가 처방됩니다 (뜨거운 알칼리성 음료, 약초 달인, mukaltin 등), 점액 용해제 (아세틸 시스테인, bromhexine, 화농성 점성 분비-단백질 분해 효소 에어로졸-키몹신, 트립신); 치료 기관지 내시경이 사용됩니다. 기관지 경련을 제거하기 위해 유필린 (정맥 주사, 좌약, 정제), 에페드린, 아트로핀이 사용됩니다. fenoterol, orciprenaline sulfate (asthmopenta) 및 새로운 국내 약물 "Soventol", 항콜린성 약물 : atrovent, troventol과 같은 교감 신경 자극제의 에어로졸에서 단일 약속이 가능합니다. 연장 된 아미노필린 (teopec, teodur, theobelong 등)의 효과적인 준비 - 하루 2 번. 이러한 요법의 효과가 없는 경우, 소량의 코르티코스테로이드를 경구(10일 15-50mg의 프레드니솔론) 또는 기관 내(하이드로코르티손 현탁액 - XNUMXmg)로 투여합니다. 추가 치료법으로 다음이 처방됩니다. 1) 진해제 : 비생산적인 기침 - 리벡신, 투수프렉스, 브롬헥신, 해킹 기침 - 코데인, 디오닌, 스톱투신; 2) 신체의 저항을 증가시키는 약물: 비타민 A, C, B군, 생체 자극제. 현재 만성 기관지염의 치료에 면역 교정 약물이 점점 더 많이 사용되고 있습니다. 내부 - catergen, 나트륨 nucleinate 또는 pentoxyl(100주 이내), levamisole(decaris). 물리 치료: 투열 요법, 염화칼슘 전기 영동, 가슴 부위의 석영, 가슴 마사지 및 호흡 운동을 처방합니다. 중등도 및 중증 기관지염과 함께 재발 방지 및 요양원 치료로 많은 환자가 지속적으로 보조 약물 치료를 받아야 합니다. 유지 요법은 기관지 개통을 개선하고 폐고혈압을 감소시키며 우심실 부전과 싸우는 것을 목표로 합니다. 악화 기간과 동일한 약이 코스에서 더 적은 양으로 처방됩니다. 예보. 완전한 회복에 대한 예후는 좋지 않습니다. 가장 불리한 예후는 폐쇄성 CB와 원위 기관지의 주된 손상이 있는 CB의 경우이며, 이로 인해 폐부전이 발생하고 폐성심이 빠르게 형성됩니다. 가장 유리한 예후는 막힘이 없는 표면(카타르) CB에 대한 것입니다. 강의 8. 호흡기 질환. 폐렴 폐렴은 호흡기 부분과 폐의 간질 결합 조직이 병리학 적 과정에 관여하는 국소 성 급성 감염성 및 염증성 질환입니다. E. V. Gembitsky의 분류(1983). 병인: 1) 박테리아(병원체를 나타냄); 2) 바이러스(병원체를 나타냄); 3) 각질층; 4) 리케차; 5) 마이코플라즈마; 6) 곰팡이; 7) 혼합; 8) 감염성 알레르기; 9) 알려지지 않은 병인. 병인에 의해: 1) XNUMX차(독립적인 급성 염증 과정); 2) 이차 (폐 순환의 순환 장애, 신장의 만성 질환, 혈액 시스템, 신진 대사, 전염병 또는 만성 호흡기 질환의 배경에 대해 발달하는 심혈관 질환의 합병증). 임상 및 형태학적 특성: 1) 실질(폐렴구균성 폐렴의 경우): croupous; 초점; 2) 전면 광고. 현지화 및 범위: 일방적; 양측. 심각도에 따라: 매우 심각합니다. 무거운; 보통의; 온화하고 낙태. 다운스트림: 날카로운; 장기간(폐렴의 방사선학적 및 임상적 해결). 병인학. 대부분의 폐렴은 감염성 기원입니다. 알레르기성 폐렴과 물리적 또는 화학적 요인으로 인한 폐렴은 드뭅니다. 세균성 폐렴은 중년 및 노년층에서 더 자주 진단됩니다. 바이러스 성 폐렴 - 젊은 사람들의 경우. 원발성 세균성 폐렴의 병인에서 주요 역할은 폐렴구균에 속합니다. 인플루엔자가 유행하는 동안 기회감염 미생물뿐만 아니라 바이러스-박테리아 연관성(보통 포도상구균)의 역할이 증가합니다. 이차성 폐렴에서 주요 병인학적 역할은 그람 음성 박테리아(클렙시엘라 뉴모니아 및 인플루엔자 바실러스)에 의해 수행됩니다. 흡인성 폐렴의 경우 혐기성 감염의 중요성이 크다. 병인. 감염성 병원체는 외부에서 기관지를 통해 폐의 호흡 부분으로 들어갑니다: 흡입 및 흡인(비인두 또는 구인두로부터). 혈행 경로를 통해 병원균은 주로 이차 폐렴이나 폐렴의 혈전 발생 중에 폐로 들어갑니다. 폐렴 발생으로 인한 림프계 감염 확산은 가슴 상처에서만 관찰됩니다. 폐에서 미생물총의 활성화로 인해 폐 조직에서 염증이 발생하는 내인성 메커니즘도 있습니다. 이차성 폐렴에서 그 역할이 크다. 폐렴의 발병은 외부 및 내부 환경의 불리한 요인에 의해 촉진되며, 그 영향으로 유기체의 일반적인 비특이적 저항 (식균 작용 억제, 박테리오 리신 생성 등) 및 국소 억제 억제가 감소합니다. 방어 메커니즘 (점액 섬모 청소 손상, 폐포 대 식세포 및 호중구의 식세포 활성 감소 등) . 폐렴의 발병기전에서 중요한 중요성은 또한 알레르기 및 자가 알레르기 반응에 첨부됩니다. 항원이되는 부생 식물과 병원성 미생물은 항원 - 항체 반응이 일어나는 호흡기 점막 세포에 고정되어 조직 손상과 염증 과정의 발달로 이어지는 항체 생산에 기여합니다. 미생물 및 폐 조직의 일반적인 항원 결정기가 있거나 폐 조직이 바이러스, 미생물, 독소 및 독성 물질에 의해 손상되어 항원 특성이 나타나는 경우 자가 알레르기 과정이 발생합니다. 이러한 과정은 병리학 적 변화의 더 긴 존재와 질병의 장기 경과에 기여합니다. 임상 사진. 주요 증후군: 1) 중독(일반적인 약점, 피로, 두통 및 근육통, 숨가쁨, 심계항진, 창백, 식욕 부진); 2) 일반적인 염증성 변화의 증후군(고열, 오한, 발열, 급성기 혈구 수의 변화: 백혈구 공식이 왼쪽으로 이동하는 백혈구 증가, ESR 증가, 피브리노겐 수준, α2-글로불린, C 반응성 단백질의 출현); 3) 폐 조직의 염증성 변화 증후군(기침 및 가래의 출현, 타악기 소리의 단축), 목소리 떨림 및 기관지 발성 증가, 호흡 빈도 및 특성의 변화, 습한 가래의 출현, 방사선학적 변화; 4) 다른 기관 및 시스템의 침범 증후군. 이러한 증상의 중증도는 폐렴 경과의 중증도를 나타냅니다(표 11 참조). 표 11 폐렴의 증상과 경과
폐렴 과정의 다양한 단계에서 폐 및 폐외와 같은 특정 합병증의 추가로 인해 임상 양상이 바뀔 수 있습니다. 폐: 농양 형성; 흉막염 (para- 및 metapneumonic), 덜 자주 - 흉막 농흉; 천식 구성 요소의 가입, 폐부종의 형성 및 급성 호흡 부전의 발병이 가능합니다. 폐외 합병증: 전염성 독성 쇼크(급성 혈관, 급성 좌심실 및 신부전, 소화관 점막의 궤양 및 출혈, 파종성 혈관내 응고의 발달, 감염성-알레르기성 심근염, 감염성 심내막염, 심낭염, 수막염 또는 수막뇌염, 신염, 간염 심한 크루프성 폐렴에서는 중독 정신병이 발병할 수 있으며 합류성 총 폐렴에서는 급성 폐 심장이 발생할 수 있습니다. 폐렴 환자의 주요 불만 사항: 기침, 가래 생성, 흉통, 호흡 및 기침으로 악화됨, 숨가쁨, 전반적인 건강 장애, 발열. 기침은 건조하거나 가래가 있을 수 있습니다(점액, 점액 화농성, 화농성-점액, 피). "녹슨"가래는 Klebsiella (Fridlander 's bacillus) 및 바이러스 성 폐렴으로 인한 폐렴의 혈소판 성 폐렴의 특징입니다. 화농성 피 묻은 가래는 연쇄상 구균 기원의 폐렴을 나타냅니다. 소량의 점액 성 가래가있는 지속적인 기침은 인후통의 느낌이 특징 인 마이코 플라스마 폐렴에서 관찰됩니다. 심호흡과 기침으로 악화되는 측면의 통증은 폐색 구균 성 폐렴의 특징이며 병리학 적 과정에서 흉막이 관여합니다. 폐의 하부에 폐렴이 국소화되고 그 과정에서 횡격막 흉막이 침범하면 통증이 복강으로 방사되어 급성 복부의 그림을 시뮬레이션할 수 있습니다. 왼쪽 폐의 위쪽 또는 아래쪽 갈대 부분이 이 과정에 관여하면 통증이 심장 부위에 국한됩니다. 환자의 25 %에서 호흡 곤란에 대한 불만이 주요 증상 중 하나이며 특히 만성 호흡기 질환 및 심부전을 배경으로 발생한 폐렴이 있습니다. 호흡 곤란의 심각성은 일반적인 웰빙의 침해와 병행하여 증가합니다. 심각한 중독의 증상은 각질 및 마이코플라즈마성 폐렴의 가장 특징적이며 포도구균, 인플루엔자 및 폐렴구균(크루푸스) 폐렴에서도 관찰됩니다. 환자는 오한과 열이 나는 체온으로 인해 불안할 수 있습니다. 중독 및 발열의 일반적인 배경에 대해 국소 증상이 나타납니다. 진단. 병인학적인 진단을 내리기 위해서는 초기에 질병의 증상을 정확하게 평가하는 것이 중요합니다. 쉰 목소리나 말을 할 수 없는 현상은 파라인플루엔자 바이러스로 인한 폐렴의 특징입니다. 아데노바이러스에 의한 폐렴은 눈물, 눈의 통증, 삼킬 때의 인후통, 호흡기의 다른 부분을 바꾸지 않고 코에서 다량의 분비물이 발생합니다. 진단에 가장 중요한 것은 폐 조직의 염증성 변화 증후군의 존재입니다. 이 증후군은 다음과 같은 증상으로 구성됩니다. 1) 흉부의 영향을받는 쪽의 호흡 지연; 2) 병변의 투영 영역에서 타악기 소리가 다소 감소합니다. 3) 동일한 영역에서 목소리 떨림 및 기관지 발성 증가; 4) 호흡의 성질 변화(단단함, 기관지, 약화 등); 5) 병리학적 호흡 소음(젖고 유성음의 미세한 기포 소리 및 가래)의 출현. 호흡의 본질은 다양한 방식으로 변할 수 있습니다. 크루프성 폐렴의 초기 단계에서는 호기가 길어지면 호흡이 약해질 수 있습니다. hepatization 단계에서 타악기 소리의 둔감함과 함께 기관지 호흡이 들립니다. 타악기의 둔함이 감소하면서 폐렴 초점의 해상도로 호흡이 거칠어집니다. 국소성 폐렴의 가장 지속적인 증상은 거친 호흡과 습하고 미세한 버블 링 로울링입니다. 그러나 중심폐문폐렴은 신체자료가 매우 열악하고 X-ray 검사를 거쳐야 폐렴의 진단이 가능하다. 마이코플라스마 폐렴은 물리적 데이터의 부족으로 구별됩니다. 매우 적은 수의 천명음과 함께 심각한 중독이 Klebsiella 폐렴으로 인한 폐렴에서 관찰됩니다. 어떤 경우에는 청진 중에 염증성 침윤 증후군의 특징이 아닌 다수의 저음 및 고음 건조음이 전면에 나타날 수 있습니다. 이것은 만성 기관지염의 배경에 대해 발전한 폐렴에서 발생합니다. 파이퍼 스틱으로 인한 폐렴; 알레르기 성분의 폐렴에 걸린 경우. 증상은 병인 진단을 내리는 데 도움이 됩니다. 1) 풍진과 같이 작은 반점의 발견, 림프절 병증과 함께 발진이 나타나는 것은 아데노 바이러스 감염의 특징입니다. 2) 림프절의 국소적 확대는 말초성 폐렴을 나타냅니다. 3) 점막, 피부 및 손발톱의 병변과 결합된 진균성 폐렴; 4) 각막폐렴과 큐리케차폐렴에서 간신증후군과 경미한 황달이 발견된다. 5) 전형적인 croupous 폐렴의 경우 환자의 모습이 특징적입니다. 병변의 측면에 열이 나는 홍당무가있는 창백한 얼굴, 헤르페스 발진, 호흡 할 때 코 날개가 부어 오릅니다. 폐렴의 존재와 이 과정에서 폐 조직의 침범 정도를 명확히 하는 가장 중요한 방법은 흉부 장기에 대한 대형 투시 및 X선 검사입니다. 포도상구균성 폐렴은 폐 병변의 명확한 분할과 그 과정에서 여러 분절이 관여하는 것으로 구별됩니다. 그들의 특징적인 방사선 학적 징후는 질병 발병 후 5-7 일째에 기흉 유형의 폐에 여러 개의 충치가 형성되고 나중에 체액이있는 괴사 성 충치가 형성된다는 것입니다. 진정한 농양과 달리 충치의 구성과 수는 빠르게 변합니다. Lobar 병변은 크렙시엘라에 의한 크룹성 폐렴 또는 폐렴의 징후입니다. 주로 오른쪽 폐인 상엽이 가장 흔하게 영향을 받습니다. 엑스레이 검사에서 흉막강에 삼출액이 보입니다. 종종 이러한 삼출은 연쇄상 구균성 폐렴에서 발생하며, Pfeiffer's stick에 의해 유발된 폐렴은 하엽에 국한되며 환자의 2/3에서 폐의 하나 이상의 엽을 포착합니다. X선 검사 데이터는 경미한 청진 변화(간질성 및 폐문성 폐렴)가 있는 폐렴을 감지하는 데 특히 중요합니다. 어떤 경우에는 진단을 명확히하기 위해 복잡한 과정 (농양, 흉강의 삼출)으로 침윤성 변화의 퇴행이 지연된 경우 진단을 명확히하는 데 도움이되는 단층 촬영 및 기관지 조영술이 표시됩니다. 그들은 유사한 임상 및 방사선 학적 표현을 가진 다른 병리학 적 과정을 배제하는 데 사용됩니다. 기관지 조영술은 악화되는 동안 침윤성 변화(주위 폐렴)가 가능한 기관지 확장증의 존재뿐만 아니라 폐 조직의 충치를 나타냅니다. 경색 폐렴 진단에서 폐 혈류에 대한 방사성 핵종 연구는 특정 역할을하여 위반 사항을 나타냅니다. 항생제를 사용하기 전에 가래(또는 기관지 세척)에 대한 세균학적 검사는 병원체를 감지하고 항생제에 대한 감수성을 결정하는 데 도움이 됩니다. 항상 확인된 미생물은 아닙니다. 폐렴의 원인균입니다. 보다 정확한 병인 진단은 면역학적 연구를 사용하여 만들 수 있습니다: 보체 고정 반응(RCC) 및 혈구응집 억제 반응(HITA) 바이러스 및 박테리아 항원. 바이러스 성 및 바이러스 성 - 세균성 폐렴의 진단에는 바이러스 학적 및 혈청 학적 연구가 중요합니다 (생쥐에 대한 생물학적 검사를 포함한 객담 배양 연구 결과, 발달중인 닭 배아에서 바이러스 배양 방법, 면역 형광법, 바이러스에 대한 쌍혈청을 이용한 혈청학적 방법은 항체가의 4배 증가만을 중요시함). 객담 검사는 폐렴의 특성을 명확히 하는 데 도움이 됩니다. 많은 수의 호산구는 알레르기 과정을 나타내며, 비정형 세포의 존재는 암 기원의 폐렴을 나타냅니다. Mycobacterium tuberculosis는 결핵에서 발견됩니다. 탄성 섬유 - 폐 조직 붕괴의 증거. 진균증 폐렴의 경우 진균의 검출과 함께 진균의 폐기물의 억제 효과로 인해 화농성 식물상의 부재가 주목됩니다. 그람 염색 가래 도말의 현미경 검사법에 따르면 환자가 병원에 입원한 첫날 이미 기관지에 서식하는 그람 음성 또는 그람 양성 미생물에 대해 이야기할 수 있습니다. 염증 과정의 중증도는 급성기 혈액 매개변수의 중증도와 그 역학(백혈구 수식의 변화에 따른 백혈구 증가, ESR 증가, α 함량 증가)에 의해 판단됩니다.2-글로불린, 피브리노겐, SRV의 출현, 시알산 수준의 증가). 장기간의 폐렴과 합병증의 발병으로 신체의 면역 학적 반응성이 연구됩니다. 체액성(IgM) 및 세포성(백혈구의 지연된 이동, T-림프구 시스템을 특징짓는 검사의 변화) 면역의 감소는 면역 조절 요법이 필요합니다. 치료. 진단 후 즉시 폐렴에 대한 etiotropic 치료를 시작해야합니다. 가능한 병원균에 대한 경험적 아이디어는 매우 중요합니다. 왜냐하면 가래에 대한 세균학적 검사는 꽤 오랫동안 수행되었으며 대부분의 환자에서 이 연구에 대한 현대적인 접근 방식을 사용하더라도 불확실하고 때로는 잘못된 결과를 제공하기 때문입니다. 현재 페니실린은 폐렴 치료에서 선택 약물로서의 중요성을 상실했습니다. 이것은 폐렴 구균 및 헤모필루스 인플루엔자 외에도 폐렴의 발병에 병인학 적으로 중요한 것은 β- 락탐 그룹의 항생제의 살균 효과에 내성이있는 필수 세포 내 미생물 인 Mycoplasma pneumoniae 및 Chlamydia pneumoniae라는 사실 때문입니다. 이러한 약물에 대한 과민 반응이 환자에서 빠르게 발생한다는 사실을 간과하는 것은 불가능합니다. 이와 관련하여 폐렴 치료에 있어 마크로라이드는 폐렴구균 뿐만 아니라 폐렴마이코플라스마, 폐렴클라니디아에도 효과가 입증된 마크로라이드에 많은 관심을 기울이고 있다. 그러나 산성 환경에서 낮은 안정성(따라서 낮은 생체이용률)과 폐렴구균 균주가 널리 퍼졌기 때문에 이 약물군의 표준인 에리트로마이신이라는 사실을 잊지 않는 것이 중요합니다. 에리스로마이신에 내성이 생겨 임상적 가치를 상실하고 있다. 선택 약물로 아지트로마이신, 록시트로마이신, 로바마이신 등 macrolide 계열의 다른 약물로 대체되었습니다. 많은 macrolide가 경구 및 비경구 사용(예: rovamycin)에도 사용됩니다. 결과적으로 폐의 염증 과정의 심한 과정에서 사용이 정당화됩니다 (예를 들어, 처음에는 로바마이신을 2-3일 동안 정맥 주사한 다음 병리학 적 과정의 긍정적 인 역학으로 환자가 다음으로 전환합니다. 이 약을 구두로 복용). 로바마이신의 장점은 오필린과 상호 작용하지 않기 때문에 부인할 수 없으며, 만성 폐쇄성 폐 질환 환자의 치료에 오필린과 로바마이신을 함께 사용하기 때문에 이러한 약물의 과다 복용 가능성을 방지합니다. 마크로라이드의 이 하위 그룹(16-원 마크로라이드)은 부작용이 최소화된 약물이라는 것도 알려져 있습니다. 65세 이상의 환자에서는 폐렴의 병인 스펙트럼의 이질성과 만성 폐쇄성 폐질환을 동반하기 때문에 초기 항생제 치료에 반합성 페니실린을 사용할 수 있으며 이 치료 후 3년간 긍정적인 효과가 없을 경우 -4일, 세팔로스포린의 사용이 정당화됩니다. I 및 일부 II 세대 세팔로스포린의 작용 스펙트럼은 그람 양성 및 그람 음성 미생물이고 III 세대 세팔로스포린은 주로 그람 음성 병원체에 작용한다는 것을 상기하는 것이 중요합니다. XNUMX세대 세팔로스포린은 세팔로틴(Keflin), 세파졸린(Kefzol) 등으로 대표되며, XNUMX세대 약물은 세푸록심(Ketocef), 세폭시틴(Boncefin) 등이 있으며, III세대 세팔로스포린은 세포탁심(Claforan), 세포페라존(Cefobideone), 롱세프 ). 흡인성 폐렴은 혐기성 또는 그람 음성 미생물총과 관련이 있으며, 이는 아미노글리코사이드 또는 500세대 세팔로스포린을 메트로니다졸-세미숙시네이트(2mg 3일 XNUMX-XNUMX회 정맥 주사)와 함께 사용하는 것을 결정합니다. 면역 결핍 상태는 또한 선택된 약물의 특성에 영향을 미치며, 이 경우 병원체의 특성에 따라 다릅니다. 이러한 경우 적용된 계획은 aminoglycosides와 현대 cephalosporin으로 구성됩니다. 폐렴 환자의 효과적인 항생제 치료 기간은 7-10일입니다. 치료를 처방 할 때 7-15 %의 경우이 치료의 효과가 없을 수 있음을 고려해야합니다. 이는 미생물 연구 결과에 따르면 항생제를 대체할 필요가 있음을 나타냅니다. 또 다른 옵션은 현대 세팔로스포린, 이미페넴, 모노박탐, 플루오로퀴놀론과 같은 소위 XNUMX차 선택 항생제인 대체 약물을 사용하는 것입니다. Fluoroquinolone(ofloxacin, pefloxacin, ciprofloxacin)은 녹농균(Pseudomonas aeruginosa) 및 일부 그람 양성 구균(Staphylococcus aureus)을 포함한 그람 음성 병원체에 효과적이지만 혐기성 세균에 노출되면 비활성화됩니다. Fluoroquinolone은 클라미디아, 레지오넬라 및 마이코플라스마 감염에서 마크로라이드의 대안으로 정당하게 고려될 수 있습니다. 현대 형태의 Monobactam 항생제는 주로 그람 음성 호기성균(Salmonella, Shigella, Proteus, Escherichia coli, Klebsiella 등)에 대해 활성인 aztreonam(azactam)으로 대표됩니다. 그리고 β-lactamase의 작용하에서도 안정하다. Imipenem - carbapenem 그룹의 항균 약물은 imipenem의 신진 대사를 억제하는 cilastatin과 함께 만 처방됩니다. 이 약물은 많은 혐기성 세균, 그람 양성 구균 및 그람 음성 간균에 매우 효과적입니다. 폐렴 치료에 사용되는 항생제 투여. 1) 페니실린: 벤질페니실린(500-000 IU를 1-000시간마다 정맥 주사 또는 000-6 IU를 8시간마다 근육 주사), 암피실린(500-000-1 g, 000시간마다 또는 000 g-4시간마다 근육 주사) 아목시실린(0,5시간마다 1,0-2,0g을 경구로, 또는 6-8시간마다 0,5-6g을 근육내, 정맥내), 옥사실린(0,5-1,0시간마다 8g을 경구, 근육내, 정맥내). 2) 세팔로스포린: I 세대 - 세팔로틴(케플린)(0,5-2,0g 4-6시간마다 근육 내, 정맥 내), 세파졸린(케프졸)(0,5-2,0g, 8시간마다 근육 내, 정맥 내), II 세대 - 세푸록심(지나세프) , ketocef) (0,75-1,5시간마다 6-8g 근육 내, 정맥 내), III 세대 - cefotaxime(claforan)(1,0-2,0g, 최대 12g/일 12시간마다 근육 내, 정맥 내), ceftriaxone(longacef, rocefin) (1,0-2,0-4,0g 매 24시간마다 근육내, 정맥내). 3) 아미노글리코사이드: 겐타마이신(80시간마다 12mg을 근육주, 정맥 주사), 아미카신(10~15mg/kg을 근육주, 정맥 주사), 토브라마이신(브루라마이신)(12~3mg/kg을 5시간마다 근육주, 정맥 주사) . 4) 마크로라이드류: 에리스로마이신(구강으로 0,5~6시간마다 8g, 정맥으로 0,5~1,0시간마다 6~8g), 로바마이신(구강으로 3,0~8시간마다 12만 IU, 1,5~3,0시마다 8만~12만 IU) 몇 시간 동안 정맥 주사). 5) 플루오로퀴놀론: 페플록사신(레플라신)(경구 400시간마다 12mg, IV), 시프로플록사신(사이프로베이)(경구 500시간마다 12mg 또는 정맥 주사 200시간마다 400-12mg), 오플록사신(자노신, 200mg) 12시간마다 구두로). 6) 테트라사이클린: 독시사이클린(비브라마이신)(200일째 1mg, 다음 날 - 100시간마다 24mg 경구), 미노사이클린(미노신)(200일째 1mg, 이후 날 - 100시간마다 12mg 경구), aztreonam(azactam)(1,0~2,0시간마다 8~12g), 이미페넴/실스타틴(thienam)(500~6시간마다 8mg을 근육주사). 또한 일반적으로 질병의 장기간 또는 진행 과정이 부적절한 초기 항생제 치료로 인한 것이라는 점도 중요합니다. 그러나 이것 외에도 폐에서 길고 지속적인 염증 과정을 초래하는 여러 가지 국소 및 전신적 원인이 있습니다. 국소 기도 폐쇄(암, 선종, 점액성 폐색 등); 기관지확장증(선천성, 후천성); 낭포성 섬유증; 면역 체계 결함(후천성); 반복적인 흡인(이완불능증, 식도암 등); 잠복 결핵 감염의 활성화; 폐 농양 발생; 부적절한 항생제 치료. 강의 9. 소화관의 질병. 식도의 질병. 식도의 식도염과 소화성 궤양 1. 급성 식도염 급성 식도염은 수일에서 2-3개월 지속되는 식도 점막의 염증성 병변입니다. 병인학 및 병인. 병인 요인: 전염병, 부상, 화상, 중독, 알레르기 반응, 영양 오류. 감염원 중 급성 식도염의 가장 특징적인 것은 디프테리아, 성홍열, 장티푸스, 장티푸스, 인플루엔자, 파라인플루엔자, 아데노바이러스 감염, 볼거리입니다. 물리적 및 화학적 손상 요인은 전리 방사선, 화학적 화상, 뜨겁고 매우 차가운 음식, 향신료로 대표됩니다. 분류. 단일 분류가 없습니다. 급성 식도염의 작업 분류를 사용하는 것이 가능합니다. 형태 학적으로 급성 식도염의 나열된 유형은 카타르, 부종, 미란, 위막, 출혈, 박리, 괴사, 가래로 구분됩니다. 병인: 감염성, 화학적, 물리적, 소화성. 내시경 단계: 1차 - 점막의 부종 및 충혈, 2차 - 부종성 점막 주름의 상단에 단일 침식의 출현, 3차 - 침식 및 출혈 점막의 초점이 있는 점막의 상당한 부종 및 충혈, 4차 - " 울음 "- 점막이 광범위하게 침식되어 내시경을 조금만 건드려도 출혈이 발생합니다. 임상 사진. 카타르성 식도염은 급성 식도염의 가장 흔한 형태입니다. 영양 오류의 배경에서 발생합니다. 매운 음식, 차갑고 뜨거운 음식을 먹을 때 경미한 부상, 알코올 화상이 있습니다. 흉골 뒤의 타는듯한 통증과 통증으로 임상 적으로 나타나며 환자는 며칠 동안 음식을 거부해야합니다. 내시경으로 관찰된 식도염 I-II 정도, x-선 - 식도의 운동과다증. 미란성 식도염은 전염병(핀, 발진티푸스, 패혈증, 진균 과정) 및 알레르기와 함께 발생합니다. 그것은 또한 화학 화상과 식도의 부상으로 나타납니다. 사실, 이러한 형태의 식도염은 카타르성 식도염의 진화 단계입니다. 주요 임상상은 기저 질환의 증상으로 구성됩니다. 임상 증상은 카타르 식도염과 유사합니다. 음식이 통과하는 동안 가슴에 심한 통증이 있습니다. 속 쓰림, 트림, 타액 과다 분비, 입에서 나는 악취(cacosmia). 내시경으로 식도염 II-III 정도의 징후를 확인합니다. 조직학적 검사에서 충혈, 점막 부종, 출혈, 미란이 나타났다. X 선 검사는 식도에 풍부한 점액, 최대 1cm 길이의 세로 모양의 평평한 바륨 저장소의 형성과 식도 벽의 과운동증으로 구호의 재구성을 보여줍니다. 출혈성 식도염은 미란성 식도염의 드문 임상 형태입니다. 병인은 미란성 식도염과 동일합니다. 심한 통증 증후군과 토혈이 임상적으로 전형적입니다. 내시경 검사에서 출혈 성분이 우세한 III-IV 등급 염증이 나타납니다. 좁은 얇은 스트립 형태로 출혈성 점막이 박리됩니다. 섬유성(가막성) 식도염. 병인학 적 요인은 성홍열, 디프테리아, 혈액 질환, 곰팡이 질환, 방사선 요법의 영향입니다. 클리닉은 연하 곤란과 심한 통증, 식사 후 악화, 메스꺼움, 구토가 지배적입니다. 구토와 함께 섬유소 필름이 방출되고 객혈이있을 수 있습니다. 내시경적으로 점막의 영향을 받는 부위에서 회색 및 황회색 섬유소 플라크가 발견되며, 이는 점막 표면을 덮고 있는 섬유소 및 찌꺼기 층에 의해 형성됩니다. 위막의 거부로 천천히 치유되는 편평한 침식이 형성되고 때로는 출혈성 궤양이 형성됩니다. 심한 감염 과정 후에 막성 협착이 식도에 남아 반복적인 부기 후에 사라집니다. 병인에 의한 막성(박리성) 식도염은 화학적(식도 화상), 전염성(원인은 패혈증, 대상 포진, 천연두, 일반 헤르페스 감염임)입니다. 질병의 클리닉은 내시경으로 진단되는 가벼운 형태에서 심각한 형태까지 다양합니다. 심한 막성 식도염의 클리닉에서는 중독, 연하 곤란 및 통증 증후군이 우세합니다. 가능한 출혈, 식도 천공, 종격동염, 일반적으로 사망으로 끝납니다. 내시경 검사에서 식도의 모든 층에 대한 손상이 관찰되며 상피는 층에 의해 거부됩니다. 기저 질환이 가라앉으면 대칭 및 비대칭 막 또는 거친 반점 협착이 때때로 식도에 남습니다. 괴사성 식도염은 드문 형태의 식도 급성 염증입니다. 패혈증, 장티푸스, 칸디다증, 말기 신부전과 같은 심각한 질병에서 면역 저하로 인해 발달이 촉진됩니다. 클리닉은 고통스러운 연하 곤란, 구토, 전반적인 약점, 출혈, 종격동염의 빈번한 발달, 흉막염, 폐렴이 특징입니다. 기저 질환을 치료한 후 식도에 협착이 남아 있어 통성 전암성 변화로 진단됩니다. 패혈성 식도염은 연쇄상 구균 병인의 식도 벽의 드문 국소 또는 확산 염증이거나 점막이 이물질에 의해 손상되어 화상, 궤양을 일으키고 이웃 기관에서 통과 할 수있을 때 발생합니다. 때때로 급성 가래성 식도염은 모든 형태의 급성 식도염의 합병증으로 발생하여 식도 벽의 화농성 융합을 유발합니다. 벽의 붕괴는 종격동 조직으로의 고름 돌파, 종격동염, 흉막염, 화농성 기관지염, 폐렴, 척추염, 대동맥 파열 또는 기타 큰 혈관의 발병을 동반합니다. 혐기성 감염에 감염되면 종격동 폐기종 또는 자연 기흉이 발생할 수 있습니다. 임상 사진은 심한 중독, 고열, 흉골 뒤 및 목 통증, 구토가 특징입니다. 검사에서 목에 붓기가 있고 척추의이 부분의 이동성이 제한됩니다. 머리의 위치는 한쪽으로 기울어 져 강제됩니다. 이 질병은 종종 화농성 종격동염으로 변합니다. 혈액 검사에서 백혈구 증가증, ESR 가속화. 급성기의 기기 검사(X-선, 내시경)는 표시되지 않습니다. 반흔 기간 동안 식도의 심한 기형과 반흔 협착증이 발생할 위험이 있으므로 엑스레이 검사가 필수입니다. 치료. 급성 식도염의 치료 원리 : 병인성, 병원성 및 증상성. 이방성 치료 - 기저 질환의 치료. 급성 식도염으로 복잡한 전염병에서는 항생제가 사용됩니다(비경구). 식도의 괴사 및 출혈성 변화가 뚜렷하면 2-3 주 동안 식사를 삼가하는 것이 좋습니다. 이 기간 동안 비경구 영양, 단백질 가수 분해물의 정맥 내 투여, 아미노산 혼합물, 지질 내, 비타민 및 해독 요법이 표시됩니다. 염증을 줄인 후 따뜻한 우유, 크림, 야채 수프, 액체 시리얼과 같은 열적 및 화학적 절약 식품이 처방됩니다. 염증의 국소 증상을 줄이기 위해 - 탄닌 1%, 칼라골 - 2%, 노보카인 - 식사 전 1-2%의 내부 용액. 수렴제는 침대 머리를 낮추고 수평 위치에서 복용합니다. 수렴성 제제의 국소 투여 효과가 없으면 비 마약 성 진통제가 비경 구적으로 처방됩니다. 식도 운동 이상증의 영향을 줄이기 위해 운동성 약물(cerucal, raglan, cisapride)을 식사 전에 경구로 사용합니다. 다중 침식으로 비스무트 제제 (denol, vikair), solcoseryl 주사가 표시됩니다. 출혈로 복잡한 출혈성 식도염의 경우 aminocaproic acid 제제, vikasol, dicynone이 사용됩니다. 대량 출혈로 혈액 또는 혈장 수혈이 처방됩니다. 화농성 괴사성 식도염의 경우 환자는 장기간 비경구 영양을 섭취해야 하며 여러 항생제를 사용한 대규모 요법이 사용되며 농양이 배액됩니다. 식도 협착은 bougienage로 교정됩니다. 드문 경우지만 위루술을 시행합니다. 예보. 카타르성 식도염과 미란성 식도염의 예후는 유리합니다. 식도염의 증상은 기저 질환이 적절하게 교정되면 자연적으로 사라질 수 있습니다. 위막성 식도염, 백화성 식도염, 점액성 식도염의 예후는 심각합니다. 모든 경우에 기저 질환이 회복되면 식도염은 흉터 협착의 형성으로 끝나고 이후 교정이 필요합니다. 식도 협착으로 인한 심각한 형태의 식도염 환자는 일을 할 수 없습니다. 급성 식도염의 예방은 기저 질환의 적절하고 시기 적절한 진단과 치료로 구성됩니다. 2. 만성 식도염 만성 식도염은 6개월까지 지속되는 식도 점막의 만성 염증입니다. 가장 흔한 변이는 소화성 식도염(역류성 식도염)이며, 이는 식도의 소화성 궤양으로 인해 복잡해질 수 있습니다. 병인학 및 병인. 질병의 주요 원인은 위 내용물이 식도로, 때로는 담즙 및 장 내용물이 지속적으로 역류하는 것입니다. 즉, 소화성 식도염은 위산에 의한 식도의 무균 화상입니다. 역류성 식도염의 발병 기전에서 산성 내용물의 역류와 식도 정화 및 비우기 위반이 중요합니다. 화학적 자극으로 인한 식도의 청소율을 식도 청소율이라고 합니다. 정상 청소에서 공격적인 분비물의 단일 역류는 역류성 식도염을 일으키지 않습니다. 뜨거운 음식, 알코올, 흡연 및 기타 외인성 요인은 식도의 청소율을 감소시킵니다. 이러한 요인에는 상당한 양의 공기를 음식과 함께 삼키는 패스트 푸드가 포함됩니다. 음식의 품질도 중요합니다. 지방이 많은 고기, 라드, 파스타, 매운 향신료는 위에서 음식이 식도로 역류하는 것을 지연시키는 데 도움이 됩니다. 약물은 하부 식도 괄약근의 색조를 현저히 감소시키고 역류를 촉진합니다: 칼슘 길항제, 질산염, 마약성 진통제, 항콜린성 약물, 테오필린 및 그 유사체, 프로스타글란딘 그룹의 약물. 소화성 식도염의 발병에서 역류의 병원성에 대한 XNUMX가지 기준이 있습니다: 빈도, 부피, 역류, 화학적 조성, 식도 점막의 상태 및 화학적 요인에 대한 민감성(벽의 염증은 민감성을 감소시킴), 배출 속도(제거율) , 주로 활성 연동 운동, 알칼리화 작용 타액 및 점액에 의존합니다. 역류성 식도염의 발병은 횡격막의 식도 개방 탈장, 십이지장 궤양, 위 절제술 후 장애 및 알레르기에 의해 촉진됩니다. 알레르기 성향도 중요합니다. 소화성 식도염 환자의 형태 학적 검사는 부종, 점막 충혈, 식도 횡격막 상부 점막하 침윤을 나타냅니다. 만성 염증의 확산에는 총 및 국소 역류성 식도염의 두 가지 옵션이 있습니다. 식도 점막의 2/3 이상의 과정에 관여하면 역류성 기관지염, 역류성 기관지염이 발생할 수 있습니다. 식도 주름의 상단에서 침식, 작은 궤양이 발생합니다(위 내용물이 있는 최대 관개 장소). 식도의 만성 염증은 경련성 구축과 기관의 단축을 유발합니다. 임상 사진. 역류성 식도염의 대표적인 증상으로는 흉골 뒤쪽이 타는 듯한 느낌, 가슴 쓰림, 누웠을 때 악화되는 역류, 연하곤란, 제산제 복용의 긍정적 효과 등이 있습니다. 협심증을 연상시키는 식사 후 가슴 통증이 발생할 수 있습니다. 역류성 식도염에서 통증의 발생은 산성 위 내용물의 역류 중 식도벽의 소화성 자극 및 경련 및 탈출된 점막의 침해와 관련이 있습니다. 이 통증의 독특한 특징: 길고 불타는 특성, xiphoid 과정의 국소화, 식도를 따라 조사, 덜 자주 가슴의 왼쪽 절반, 제산제 복용으로 인한 눈에 띄는 효과 없음, 진경제, 특히 후에 수평 위치에서 증가 먹기. 흉골 뒤의 덩어리 느낌, 뜨거운 음식이 식도를 통과하는 느낌과 같은 연하 곤란의 경미한 증상에 대해서는 임상 진단에 특히 주의해야 합니다. 점차적으로 식도염이 시작되는 징후는 타액 분비 및 음식과 함께 물을 마시는 습관일 수 있습니다. 역류성 식도염 환자의 신체 검사는 진단적으로 중요한 정보를 제공하지 않습니다. 역류성 식도염의 합병증에는 출혈, 궤양, 협착, 식도 단축, 악성 종양 등이 있습니다. 만성 역류성 식도염은 축 열공 탈장의 발달로 이어질 수 있습니다. 진단 및 감별진단. 이 병리학에 대한 가장 귀중한 연구 방법은 내시경 검사이며, 그 동안 충혈, 부종 및 점막 주름이 두꺼워집니다. 점막을 덮는 흰색 코팅은 신뢰할 수 있으며 질병의 초기 단계에서는 얇고 거의 눈에 띄지 않지만 과정이 길며 거대한 흰색 또는 더러운 회색입니다. 일부 지역에서는 흰색 플라크를 배경으로 식도의 밝은 빨간색 점막이 종종 보입니다. 어떤 경우에는 줄무늬 형태의 침식성 및 궤양성 결함이 감지됩니다. 점막의 변화는 식도염의 4단계, 즉 충혈에서 "울음" 점막까지의 단계 중 하나에 해당할 수 있습니다. 식도염이 심하면 내강에 타액과 점액이 많이 축적됩니다. 내시경 검사와 달리 pH 측정법을 사용하면 식도 청소율을 보다 객관적으로 평가할 수 있습니다. 엑스레이에서는 위식도 역류가 나타납니다. 역류성 식도염은 위와 십이지장의 소화성 궤양, 관상 동맥 심장 질환, 만성 담낭염 및 췌장염과 구별해야합니다. 감별 진단의 주요 증상은 통증입니다. 소화성 궤양과의 구별은 식도와 위의 내시경 검사에서 얻은 데이터뿐만 아니라 식도염의 늦은 "배고픈"통증이 없기 때문에 도움이됩니다. 식도염과 달리 관상 동맥 통증은 신체적, 정서적 스트레스, 질산염의 영향, 자전거 인체 측정법에 따른 것을 포함하여 ECG에 대한 허혈 징후와 관련이 있습니다. 복부 장기의 초음파 데이터는 통증 증후군의 원인으로 담낭과 췌장의 병리를 배제하는 데 도움이됩니다. 치료. 역류성 식도염의 치료에는 이를 유발한 질병의 치료와 항역류 요법의 처방이 포함됩니다. 환자는 체중을 들어 올리거나 구부리는 것을 피하는 것이 좋습니다. 휴식과 수면 중에 올바른 자세를 취해야 합니다(헤드 보드는 15-20° 각도로 30-50cm 올라갑니다). 체중을 정상화하고 부분적으로 먹는 것이 좋습니다 (마지막 식사 - 취침 3 시간 전). 술과 매운 음식은 식단에서 제외됩니다. 점막에 보호 효과가있는 흡착제 및 알칼리화 약물을 지정하십시오. 이러한 물질에는 Venter가 포함되며, 이는 하루에 1번 식전 30-40분에 3g(현탁액 형태가 바람직함)과 취침 시간에 공복시에 4회 투여됩니다. 치료 과정은 8-10 주입니다. Almagel, phosphalugel, maalox, gastal도 비슷한 효과가 있습니다. 이 약물은 완전 관해가 나타날 때까지 소화기(식사 후 1/2-2시간 및 밤)에 사용됩니다. Phosphalugel과 Maalox는 하루에 1-2회 2-3 패킷, 하루에 2-3 정으로 처방됩니다. 부르제의 혼합물인 차소다는 백토의 효율성이 불충분하여 사용하지 않는 것이 좋습니다. 포위 및 수렴 작용에는 질산 비스무트 1g이 하루에 3-4회 있습니다. 새로운 제산제인 토팔칸(topalkan)의 높은 항역류 활성이 관찰되었습니다. 광천수 - "Borjomi", "Essentuki No. 4", "Jermuk", "Smirnovskaya"는 알칼리화 효과가 있습니다. 산성 위 분비를 줄이기 위해 H 차단제가 처방됩니다.2히스타민 수용체(시메티딘, 라니티딘, 파모티딘), Ka-K-ATPase 억제제(오메프라졸), 정수리 세포의 M-콜린성 수용체의 선택적 차단제, 그 유사체 buscopan. 시메티딘은 400일 2회 300mg, 라니티딘 40mg, 파모티딘 30mg은 저녁 식사 후 저녁에 40회 처방됩니다. 오메프라졸은 내성 형태의 미란성 및 궤양성 역류성 식도염에 권장됩니다. 그것은 3-4주 동안 하루에 2-1mg으로 처방됩니다. 역류성 질환에서 운동 대피 장애를 정상화하기 위해 metoclopramide (cerucal, raglan, perinorm, biomral), prepulsid (sizepride, motilium, domperidone, coordinax)가 처방됩니다. Metoclopramide와 그 3세대 유사체는 하부 식도 괄약근의 긴장도를 높이고 위내 압력을 낮추며 위로부터의 배출을 가속화합니다. 메토클로프라미드 4정을 식사 전에 하루 2-2회 또는 하루 XNUMX회 XNUMXml를 근육주사합니다. 약물은 일반적으로 잘 견딥니다. 사용시 구강건조, 졸음, 이명 등이 나타날 수 있으며 이는 식후 감소합니다. Sizepride는 새로운 위장 운동 촉진제입니다. 하부 식도 괄약근의 긴장도를 높이고 식도 청소율을 개선하며 소화관의 운동 배출 기능을 향상시키고 병적 역류(위식도 및 십이지장위)를 억제합니다. 이 약물은 메토클로프라미드와 달리 도나민 수용체를 차단하지 않으며 항콜린성 수용체의 직접적인 자극제가 아니며 세루칼 및 그 유사체에 고유한 부작용이 없습니다. 그것은 하루에 5-10 번 2 또는 3 mg으로 구두로 처방됩니다. 치료 과정은 2-3 주에서 2-3 개월 지속됩니다. 역류성 식도염이 있는 세사프라이드는 단독 요법으로 사용할 수 있습니다. 예후 및 예방. 삶과 일에 대한 예후는 유리합니다. 복잡한 경우에는 의료의 적시성과 질에 따라 예후가 결정됩니다. 심각한 질병이 있는 환자는 장애 그룹으로 분류됩니다. 만성 역류성 식도염 환자는 위장병 전문의의 감독하에 있어야합니다. 내시경 및 형태학 연구는 악성 가능성으로 인해 최소 2년에 XNUMX회 표시됩니다. 3. 식도의 소화성 궤양 식도의 소화성 궤양은 활성 위액의 영향으로 말단 식도 점막의 궤양이 특징인 급성 또는 만성 질환입니다. 병인학 및 병인. 식도의 만성 소화성 궤양은 역류성 식도염과 열공탈장으로 인한 합병증입니다. 내부 짧은 식도, 점막의 국소 화생, 위 점막의 식도 이소증, 심장 기능 부전으로 인한 역류 질환, 빈번한 구토를 동반하는 질병 (미주신경절개 후 증후군, 구심성 루프 증후군, 만성 알코올 중독)에 의해 발생이 촉진됩니다. 식도의 급성 궤양은 식도 점막의 병리학 적 건조 (건조증), 약물 알레르기, NSAID 사용, 곰팡이 감염, 바이러스 감염, 피부 화상 및 중추 신경계 질환으로 가능합니다. 이러한 궤양은 증상이 있는 것으로 간주됩니다. 임상 사진. 일부 환자는 식도와 위십이지장 부위의 점막에 궤양성 병변이 결합되어 있습니다. 식도의 소화성 궤양의 증상은 소화성 식도염의 임상상과 유사합니다. 지속적인 가슴 앓이, 식사 후 악화, 구부릴 때, 누워있는 자세, 역류, 삼킬 때의 통증, 고형 음식 통과 장애. 식도궤양의 전형적인 합병증: 천공, 출혈, 침투, 협착. 출혈은 토혈, 흑색변, 저색소성 빈혈, 심장 활동 감소로 나타납니다. 식도 천공은 극히 드물게 진단됩니다. 천공의 임상 증상은 이물질에 의한 급성 관통 및 비관통 기계적 손상의 증상과 구별할 수 없습니다. 식도 궤양의 약 14%가 주변 조직으로 침투합니다. 진단 및 감별진단. 임상 증상을 토대로 소화성 궤양을 의심하는 것은 극히 어렵습니다. 진단은 도구 및 실험실 연구 중에 확인됩니다. 가장 유익한 것은 엑스레이 및 내시경 검사입니다. 방사선학적으로 궤양은 점막 주위에 약간의 부종이 있는 심장상위 식도의 틈새로 나타납니다. 궤양 부위의 식도가 경직적으로 수축되고 그 위에 약간의 협착상 확장이 감지됩니다. 궤양에는 운동과민증과 역류성 식도염의 징후가 동반되며, 열공탈장 증상이 매우 흔합니다. 때때로 궤양은 작은 횡격막 게실과 유사하지만 후자는 전형적인 임상 경과가 없으며 심부전, 탈장 또는 식도염과 결합되지 않습니다. 식도의 소화성 궤양을 방사선학적 징후로 벽의 강직과 점막의 완화 및 비대칭 샤프트를 동반하는 궤양성 내생암과 구별하기가 더 어렵습니다. 식도의 소화성 궤양의 확인에서 가장 신뢰할 수 있는 정보는 내시경 및 궤양의 가장자리에서 다중 생검으로 제공됩니다. 내시경을 소화성 궤양으로 옮기면 I-IV기 식도염의 징후, 식도의 운동 기능 장애, 주변부 부종 및 점막 충혈이 나타납니다. 급성 궤양은 일반적으로 둥글거나 타원형이며 가장자리가 가파르고 희끄무레하거나 녹색으로 덮여 있습니다. 만성 궤양은 조밀하고 고르지 않은 벽, 부드러운 가장자리, 화농성 섬유소 침착물, 과립의 초점 및 반흔성 오버레이가 있는 평평한 바닥을 가지고 있습니다. 악성 종양을 배제하기 위해 궤양 가장자리에서 4-6개의 생검을 채취합니다. 내시경 검사는 식도의 축을 따라 길쭉한 단일 소화 결함을 보여줍니다. 길이는 1-10cm 내에서 다양하지만 더 자주는 1cm를 초과하지 않으며 궤양은 종종 얕고 바닥은 희끄무레 한 코팅으로 덮여 있습니다. 충혈, 점막 부종 및 단일 미란은 종종 중간 정도의 국소 염증 반응을 반영합니다. 소화성 궤양의 치유 후, 거친 선형 또는 별 모양의 흉터 또는 벽의 거친 게실형 기형 및 내강의 협착이 식도에 남아 있습니다. 특정 성질의 궤양 (결핵, 매독)으로 식도의 소화성 궤양을 구별하는 것이 필요합니다. 이러한 상황에서 특정 혈청 학적 검사, 조직 학적 및 세균 학적 연구 결과가 크게 도움이됩니다. 식도의 병리와 폐 및 기타 기관 손상의 조합으로 인해 특정 과정과 관련하여 환자를 의도적으로 검사해야 합니다. 치료. 치료에는 식이요법이 포함됩니다. 기계적, 화학적으로 부드러운 음식을 권장하며 하루에 5~6회 소량씩 섭취합니다. 위의 내용물이 식도로 역류하는 것을 방지하기 위해 환자의 침대 자세는 침대 머리 부분을 높여야 합니다. 약은 누워서 복용합니다. 단일 요법은 제산제 및 흡착제를 포함한 항분비제, 위 운동 대피 기능 자극제 (동력학), 약물-점액 시뮬레이터 등 약리학 그룹 중 하나의 약물로 처방됩니다. 치료는 1,5-3개월 동안 오랫동안 수행됩니다. 외과 적 치료에 대한 적응증 - 6-9 개월 이내에 치유 부족, 복잡한 과정 (천공, 침투, 협착, 출혈). 예후 및 예방. 질병의 진행 과정이 재발하고 있습니다. 삶과 일에 대한 예후는 유리합니다. 내시경과 생검을 통해 위장병 전문의가 외래에서 정기적(1년에 2~XNUMX회) 검사를 하는 것이 좋습니다. 역류성 식도염의 계절 (봄-가을) 예방이 수행됩니다. 강의 10. 소화관의 질병. 위장의 질병. 만성 위염 만성 위염은 임상 적으로 위 소화 불량, 형태 학적으로 위 점막의 염증 및 퇴행성 변화, 손상된 세포 재생 과정, 점막 자체 막의 형질 세포 및 림프구 수의 증가로 특징 지어지는 질병입니다. 병인학 및 병인. 현재 위장병학 발달 단계에서 만성 위염의 출현은 헬리코박터 파일로리(HP)의 미생물 확장에 의해 촉진되는 것으로 확인되었으며, 이는 95%의 경우 전정부 위염을, 56%의 경우 범위염을 유발합니다. 차례로, 만성 위염의 발생에 대한 소위 병인 요인은 위험 요인(불규칙한 불균형 식단, 흡연, 알코올 섭취, 염산 및 펩신의 과분비)에 대한 높은 확실성과 함께 기인할 수 있습니다. 질병 발병의 주요 역할은 또한 위 점막의 정수리 세포에 대한 항체 축적, 유전 악화 및 위 점막에 손상을주는 약물의 사용을 동반하는자가 면역 기전에 속합니다. 분류. 1990년 호주에서 열린 IX 국제 위장병학자 회의에서 시드니 시스템이라고 불리는 만성 위염의 새로운 체계화가 채택되었습니다. 분류의 조직 학적 기초. 1) 병인: HP와 관련된 만성 위염, 자가면역, 특발성, 급성 약물 유발 위염. 2) 지형: antral, funic, pangastritis. 3) 형태: 급성, 만성, 특수 형태. 내시경 분류 기준: 1) 위장의 위염; 2) 위장의 위염; 3) 위염; 4) 위 점막의 변화: 부종, 홍반, 점막 취약성, 삼출물, 편평한 미란, 상승된 미란, 주름 증식, 주름 위축, 혈관 패턴의 가시성, 점막상 출혈. 임상 사진. 만성 위염은 내과 진료소에서 가장 흔한 질병 중 하나입니다. 세계 주민 중 그 빈도는 28~75%입니다. 만성 위염은 위 소화 불량의 증상과 상복부 통증이 더 자주 나타납니다. 드물게 무증상입니다. 통증은 일반적으로 상복부 부위에 국한됩니다. 음식 섭취와 함께 발생하는 것과 위장에서 염증 과정의 국소화 사이에는 분명한 연관성이 있습니다. 위의 심장 하부 및 심장 부분의 위염 환자의 경우 상복부 부위의 통증은 식사 후 10-15 분에 발생하며 위장의 병리학은 식사 후 40-50 분입니다. "늦은", "배고픈", 통증은 위의 출력 부분의 위염 또는 십이지장염에 전형적입니다. "XNUMX파"통증 - 식사 후 및 공복시 - 심장하 및 전두염의 위염에서 관찰됩니다. 확산 과정을 통해 통증은 상복부 부위에 국한되고 식사 후에 발생하며 압박감이 있습니다. 그들은 상복부 부위의 통증과 그것이 기원이 내인성 일 때 발생하는 병변 사이의 관계를 확립하는 것이 불가능할 때 위염의 무증상 과정에 대해 말합니다 (위염은 다른 기관 및 시스템의 병리학에 이차적입니다). 만성 위염의 임상 양상에서 똑같이 중요한 위치는 메스꺼움, 트림 (신맛, 쓴맛, 썩은 것), 속쓰림, 변비 또는 설사, 불안정한 변과 같은 소화 불량 증후군입니다. 고립성 위염의 경우 염산과 펩신의 과분비로 인한 속쓰림과 변비가 가장 중요합니다. 심한 위축의 징후가있는 위염, 메스꺼움, 트림 "썩은", 불안정한 대변 또는 설사가 우세하며 이는 염산 및 펩신의 저분비에 일반적입니다. 지속적인 메스꺼움은 담낭의 저운동 운동 이상증과 함께 발생하는 만성 췌장염, 만성 담낭염에서 이차성 위염의 특징입니다. 진단. 만성 위염은 시간이 지남에 따라 증상이 증가하면서 오랫동안 지속됩니다. 악화는 영양 장애로 인해 유발됩니다. 만성 위염의 신체상은 다소 좋지 않습니다. 질병이 악화되는 동안 환자의 80-90%에서 객관적인 연구는 상복부 부위의 국소 통증만을 결정합니다. 만성 위염이 십이지장염, 담낭염 또는 췌장염과 결합되면 위염에는 일반적이지 않지만 다른 장기의 병리학 적 특징 인 통증의 국소화가 결정될 수 있습니다. 일반 혈액 및 소변 검사, 만성 위염 환자의 혈액 생화학적 매개변수는 건강한 개인의 해당 매개변수와 다르지 않습니다. scatological 연구에서 분석에 변화가 없거나 소화 장애의 징후가있을 수 있습니다. pH 측정을 통해 위산 분비물의 위 내용물을 연구할 때, 위산 과다분비의 징후와 산 생성 감소가 모두 나타납니다. 만성 위염에서 펩신 형성의 지표는 확산 장기 손상의 지속적인 산성의 배경에 대해 더 지속적이고 감소합니다. 엑스레이 검사는 위의 다른 질병(궤양, 암)을 배제할 가능성이 높으며, 만성 위염의 진단을 확인하는 것보다 메네트리에병의 진단에 도움이 됩니다. 질병의 임상 증상이 적고 실험실 검사의 비 특이성으로 인해 만성 위염의 진단은 내시경 및 형태 학적 연구 결과를 기반으로합니다. 내시경 검사는 부종, 홍반, 점막의 취약성, 삼출물, 편평한 미란, 융기된 미란, 주름의 증식 또는 위축, 혈관 패턴의 가시성, 점막하 출혈과 같은 다양한 중증도의 위 점막의 중증도 변화를 보여줍니다. 그들은 점막의 자체 막에서 형질 세포 및 림프구 수가 증가하는 만성 위염에 대해 말합니다 (급성 위염과 달리 다형 핵 백혈구가 나타날 때). 상기와 관련하여, 위염에서 염증의 형태학적 식별은 임상의 데이터의 해석과 일치하지 않을 수 있습니다. 위점막의 염증 변화 활성은 고유판 또는 상피의 백혈구 침윤 정도에 따라 형태학적 및 형태학적으로 평가된다. 자가면역성 위염이 활성화되지 않는다는 사실을 간과해서는 안 됩니다. 형태학적 변화(약함, 중등도 및 중증) - 염증, 활동, 위축, 화생 - 및 HP 오염 정도를 정량화합니다. 위염의 특징적인 임상 증상은 소화 시스템의 다른 질병에서도 관찰되므로 진단 과정에서 복강 초음파, 소화 기관의 철저한 내시경 및 형태 검사가 필요합니다. 차동 진단. 가장 어려운 것은 위의 기능성 질환, 위와 십이지장의 소화성 궤양, 만성 담낭염과 췌장염, 위암을 동반한 위염의 감별진단이다. 위의 기능적 질환은 만성 위염과 유사하게 잠복적으로 발생하거나 통증 및 소화불량 증상을 동반할 수 있습니다. 그들은 짧은 기간, 질병의 임상 양상에서 우세한 일반적인 신경 증상 (예 : 약점, 피로, 과민성, 두통, 불안정한 기분, 발한)의 존재가 특징입니다. 위장 기능 장애의 경우 통증은 음식의 품질에 의존하지 않거나 엄격하게 정의된 제품을 사용한 후에 발생합니다. 분비 기능이 증가된 위염과 달리 식사 후에는 증가하지 않지만 흥분으로 음식을 오래 끊는 산증(속쓰림, 신맛이 나는 분출, 입안의 신맛) 증후군이 종종 있습니다. 위장의 기능적 병리학에서의 구토는 조건 반사의 메커니즘에 따라 발생하고 환자에게 구호를 가져오고 일반적인 상태를 크게 악화시키지 않습니다. 만성 위염에서는 일반적으로 악화 중에 발생하며 환자에게 안도감을 주지 않습니다. 위장 기능 장애의 빈번한 증상은 큰 공기 분출입니다. 만성 위염에서는 음식의 소화 장애 또는 위 운동성과 관련이 있으며 분비물이 보존되면 산성이 될 수 있고, 감소되면 썩은 계란 냄새가 날 수 있습니다. 위염의 위 분비에 대한 연구에서 정상적인 분비 수치는 질병 초기에 감지되며 앞으로는 위액 분비가 감소하는 경향이 있습니다. 위장의 기능적 질병으로 이질염이 종종 관찰됩니다. 위의 X 선 검사를 통해 위염의 형태를 강직, angraal, 거대 증식, 용종증과 같은 형태로 확인할 수 있으며 위의 운동 기능을 위반하는 경우 (gastroptosis, 저혈압) 기능적 특성을 나타냅니다. 질병. 만성 위염과 위의 기능적 질환의 감별 진단을 위한 가장 가치 있는 연구 방법은 위내시경으로, 논란의 여지가 있는 경우에는 위염의 특징인 위점막의 변화나 위의 기능적 질환을 확인할 수 있습니다. 소화성궤양을 동반한 만성위염의 감별진단은 다음 강의에서 설명한다. 위암은 분비 기능이 저하된 위염과 매우 유사한 양상을 보입니다. 특히 장기간 위염을 앓고 있는 환자의 경우 임상 징후에 의한 위암의 조기 진단은 어렵다. 암 진단에 매우 중요한 것은 지속적이고 지속적인 통증의 출현, 음식 섭취에 거의 의존하지 않는 것, 동기가 없는 전반적인 약화 및 피로, 식욕 왜곡, 환자 체중의 점진적인 감소입니다. 촉진시 종양의 감지는 암 과정의 후기 단계를 나타냅니다. 환자의 건강 상태 변화, 위액의 산성도의 급격한 감소, 염산의 "결핍", 위액의 비정형 세포의 출현, 대변의 잠혈에 대한 양성 반응과 같은 증상은 의사가 위암을 의심하게 합니다. 감별 진단에서 결정적으로 중요한 것은 위 점막의 표적 생검을 사용한 X선 및 위경 검사입니다. 분비 기능이 저하된 만성 위염 환자의 경우 X-선 검사에서 점막의 위축이 나타나며 이는 위내시경으로도 확인됩니다. 이러한 경우 표적 생검을 통해 점막의 구조적 변화와 위축이 드러납니다. 위암의 경우 X 선 검사는 충전 결함의 존재, 점막 주름의 부재 또는 그 성질의 변화, 특정 부위의 연동 부재가 특징입니다. 위 내시경을 통해 종양이 여전히 위점막 내에 있을 때 발생 초기에 종양을 발견할 수 있으며 90% 이상의 경우에서 외과적 치료로 회복됩니다. 만성 담낭염. 만성 담낭염에서는 통증이 오른쪽 hypochondrium에 국한되어 있으며 둔한 느낌을 줍니다. 결석성 담낭염의 경우 통증은 급성이고 복통이며 오른쪽 견갑골 하 부위로 방사됩니다. 통증의 시작은 기름진 음식을 먹거나 급격하게 운전하는 것과 관련이 있습니다. 만성 위염에서 상복부의 통증은 확산되고 둔하고 방사선이 없으며 건조한 음식을 먹거나식이 요법을 위반 한 직후에 발생합니다. 위염과 담낭염의 경우 통증이 소화불량 증상을 동반하지만, 상복부의 무거움, 포만감, 음식이나 공기의 트림, 입안의 금속성 맛이 위염의 특징입니다. 만성 위염에서 구토는 드뭅니다. 객관적으로, 만성 담낭염, 특히 결석에서는 만성 위염의 특징이 아닌 전복벽의 긴장, 오른쪽 hypochondrium의 피부 과민증을 발견합니다. 만성 담낭염의 경우 복부 촉진시 담낭의 국소화에 통증이 나타납니다. 만성 위염은 광범위한 통증이 특징입니다. 만성 담낭염 환자에서 담즙 검사는 점액과 백혈구의 양이 증가함을 보여줍니다. 만성 위염은 위장의 다른 기능(흡수, 운동)뿐만 아니라 위액의 분비 및 산도 변화의 배경에 대한 담즙의 정상적인 모습을 특징으로 합니다. 만성 담낭염 환자의 담낭에 대한 엑스레이 검사는 담석뿐만 아니라 배출 기능의 변화를 보여줍니다. 만성 췌장염. 만성 췌장염에서는 통증이 복부의 왼쪽 절반에 국한되어 왼쪽 견갑골 하 부위, 허리 및 주변 부위로 방사됩니다. 통증의 발생은 풍부하고 종종 지방이 많은 음식과 알코올의 섭취와 관련이 있습니다. 만성 위염이 질병의 길고 단조로운 과정을 특징으로한다면 만성 췌장염에서는 단계적입니다. 만성 췌장염의 경우 객관적인 검사에서 왼쪽 hypochondrium의 피부 과민증이 나타나며 통증은 지형 학적으로 췌장의 위치에 해당합니다. 만성 췌장염의 췌장액에 대한 실험실 연구에서 알칼리도와 효소의 지속적인 변화가 발견되었습니다. 혈액과 소변의 디아스타제 수치가 변할 수 있지만 이는 만성 위염의 경우가 아닙니다. 방사선학적으로 만성 췌장염은 십이지장 고리의 역전 증가, 주요 유두의 급격한 증가(프로스트버그 증상), 때로는 췌장 석회화 부위의 존재가 특징입니다. 다양한 형태의 만성 위염에 대한 내부 진단도 수행해야 합니다. 따라서 HP와 관련된 질병은 임상적으로 십이지장 궤양의 증상으로 진행되며 경우에 따라 잠복적으로 진행될 수 있습니다. 내시경 및 형태학적 검사에서 트로필로십이지장염이 발견되었습니다. 헬리코박터 파일로리 위염의 침식은 일반적으로 심한 염증 부위(위의 인위성 구역)에 국한됩니다. 자가면역 만성 위염은 임상적으로 상복부 부위의 무거움, 입안의 불쾌한 뒷맛, 썩은 트림 및 메스꺼움을 특징으로 합니다. 염산 생성이 부족하여 설사가 나타납니다. 10 %의 경우자가 면역 위염의 배경에 대해 증상이 발견됩니다. B12- 결핍성 빈혈: 혈액 검사에서 쇠약, 피부 및 점막의 창백함, 부서지기 쉬운 손발톱 - 과색소성 거대적아구성 빈혈. 질병의 특별한 형태는 육아종성, 호산구성, 비대(메네트리에병), 림프구성 위염을 포함합니다. 육아종성 위염은 더 심각한 병리학(크론병, 결핵, 유육종증)의 구성 요소 중 하나인 질병의 독립적인 형태로 작용합니다. 진단은 항상 위 점막의 생검 표본의 조직 검사 결과에 의해 확인됩니다. 호산구성 위염은 극히 드물며 전신 혈관염에 의해 발생합니다. 알레르기 반응의 병력은 필수입니다. 조직학적 검사는 위 점막의 호산구성 침윤을 보여줍니다. 비후성 위염(메네트리에병)은 임상적으로 상복부 통증과 메스꺼움으로 나타납니다. 일부 환자는 설사로 인해 체중 감소를 경험할 수 있습니다. 내시경, 방사선 및 형태학 연구에서 뇌의 회선과 유사한 거대한 비대 점막 주름이 발견됩니다. 림프구성 위염은 임상적으로 무증상입니다. 형태학적으로, 이 형태는 림프구에 의한 위 점막의 뚜렷한 침윤이 특징입니다. 치료. 위염 환자는 규칙적인 균형 잡힌 영양 섭취, 업무 및 휴식 일정의 정상화, 일상 생활과 업무에서 스트레스가 많은 상황을 완화하는 등 일반적인 의료 조치가 필요합니다. 약물 요법은 만성 위염의 임상 증상이 있는 경우에만 표시됩니다. HP와 관련된 위염 환자는 소화성 궤양 프로그램으로 치료됩니다(다음 강의 참조). 자가면역 위염 환자는 비타민 B 보충이 필요합니다.12 (500mcg를 1일 동안 하루에 한 번 피하 투여한 후 치료 과정을 반복함), 엽산(하루 30mg), 아스코르브산(하루 최대 5g). 필요한 경우 효소 제제 (mezim-forte, festal, enzistal, creon, pancitrate, acidin-pepsin)로 대체 요법이 수행됩니다. 통증 증후군은 보통 중간 치료 용량의 제산제(maalox, almagel, gastal) 또는 H-히스타민 수용체 차단제(ranitidine, famotidine)를 투여하면 중단됩니다. 특별한 형태의 위염의 경우 기저 질환의 치료가 필요합니다. 예후 및 예방. 삶과 일에 대한 예후는 유리합니다. 만성 위염 환자는 위장병 전문의에게 등록해야 합니다. 종양 변형을 배제하기 위해 적어도 1년에 한 번 생검을 통해 임상 및 내시경 검사를 받습니다. 암 변성 측면에서 가장 위험한 것은 상피 이형성증을 동반한 비대성, 미만성 위축성 위염입니다. 메네트리에병의 비보상적 형태뿐만 아니라 출혈로 복잡한 미란성 형태의 질병에서 예후는 외과적 치료의 적시성과 적절성에 의해 결정됩니다. 위염 예방은 합리적인 영양 섭취, 작업 및 휴식 체제 준수, NSAID 섭취 제한으로 축소됩니다. 강의 11. 소화관의 질병. 위장의 질병. 소화성 궤양 소화성 궤양 (소화성 궤양)은 위 십이지장 구역의 기능적 병리학 및 형태 학적으로 - 점막 및 점막하 층의 무결성을 위반하여 임상 적으로 나타나는 만성 재발 성 질환이므로 궤양은 항상 형성과 함께 치유됩니다. 흉터의. 병인학. 소화성 궤양 질환의 주요 원인은 위 상피 표면의 HP의 미생물 확장입니다. 질병의 병인에서 박테리아 공격의 중요성은 J. Warren과 B. Marshall이 위 전두 상피 표면에서 많은 수의 S-나선형 박테리아의 발견을 보고한 1983년 이래로 연구되었습니다. 헬리코박테리아는 요소(혈류에서)를 암모니아와 이산화탄소로 전환시키는 요소분해효소의 생산으로 인해 산성 환경에서 존재할 수 있습니다. 효소 가수분해의 산물은 염산을 중화하고 각 세균 세포 주변 환경의 pH를 변화시키는 조건을 만들어 미생물의 생명 활동에 유리한 조건을 제공합니다. 총 HP 집락화는 포스포리파제의 작용하에 상피 손상을 동반하는 위 상피 세포의 표면에서 발생합니다. 후자는 담즙에서 독성 레시틴과 단백질 분해 효소를 형성하여 보호 단백질 복합체와 점액을 파괴합니다. 암모니아로 상피 세포막의 "알칼리화"를 배경으로 세포의 막 전위가 변하고 수소 이온의 역확산이 증가하며 위 점막 상피의 사멸 및 박리. 이러한 모든 변화는 HP가 위 점막 깊숙이 침투하도록 합니다. 소화성 궤양의 발병에 덜 중요한 것은 신경 정신병적 영향, 유전적 소인, 감염원, 소화 불량 및 특정 약물 복용, 나쁜 습관입니다. 처음으로 질병의 발병에 대한 신경인성 개념은 Bergman에 의해 공식화되었으며, 그는 자율신경계의 유전적 체질 장애가 위벽의 근육과 혈관 경련, 허혈 및 감소를 초래한다고 주장했습니다. 위액의 공격적인 영향에 대한 점막의 저항. 이 이론은 K. N. Bykov와 I. T. Kurtsin(1952)에 의해 더욱 발전되었습니다. 그들은 만성 신경정신적 외상으로 인한 더 높은 신경 활동의 변화에 대한 데이터를 기반으로 하는 궤양 발생의 피질 내장 이론을 입증했습니다. 위 분비, 운동성 및 영양 조절에서 생화학적 및 호르몬적 연결의 교리에 의해 보완되고 자세히 설명된 이 궤양 형성 이론은 최근 몇 년 동안 다시 많은 지지자를 얻었습니다. 주요 신경 과정의 관성, 혈액의 그룹별 특성, 면역학적 및 생화학적 특징, 유전적 부담 증후군과 같은 유전적 요인은 연구자들 사이에서 인기가 있습니다. 소화성 궤양의 발생에서 소화 불량이 본질적으로 중요했습니다. 그러나 대부분의 경우 지난 XNUMX년 동안 수행된 임상 및 실험 연구에서 위십이지장 점막에 대한 식품의 손상 효과가 밝혀지지 않았습니다. 다양한 식이 습관을 가진 사람들 사이에서 소화성 궤양 질환의 유병률은 영양 요소의 주요 중요성을 입증합니다. 영양의 리듬과 규칙성의 장애, 식사 사이의 긴 휴식, 제때의 식사는 소화성 궤양의 발생에 필수적입니다. 연구자들은 궤양 형성에서 알코올의 역할에 대해 상대적으로 상반된 견해를 표명했습니다. 알코올은 위 점막의 위축성 변화를 일으키는 것으로 알려져 있습니다. 이러한 관찰은 궤양 형성의 일반적인 개념과 상충됩니다. 그러나 알코올을 자주 사용하면식이 요법 위반, 음식 구성의 질적 변화가 동반되어 궁극적으로 위와 십이지장의 소화성 궤양을 유발할 수 있습니다. 궤양 발생에서 의약 효과의 역할은 활발히 연구되고 있습니다. 문헌과 우리 자신의 데이터에 발표된 연구 결과에 따르면 비스테로이드성 항염증제와 글루코코르티코이드 호르몬이 가장 두드러진 궤양 유발 특성을 가지고 있습니다. 병인. 소화성 궤양 질환의 발병기전은 아직 완전히 이해되지 않았습니다. 궤양 발생 과정을 고려할 때 다음과 같은 몇 가지 가정을 강조할 필요가 있습니다. 1) 소화성 궤양 악화의 계절성을 특징으로합니다. 2) antropyloroduodenal zone에 소화성 궤양의 국소화가 지배적입니다. 3) 위액에서 염산과 펩신의 존재가 관찰되었습니다. 4) 위 및 십이지장 궤양의 자발적 치유 빈도(최대 70%)가 눈에 띕니다. 5) HP와 관련된 만성 위염이 있습니다. 6) 위의 인위 부분과 십이지장의 초기 부분은 위장관의 "시상 하부"입니다. 7) 소화성 궤양의 발생에 유전적 소인이 있습니다. 8) 위의 모든 요인이 있는 경우 궤양의 발생, 재발 및 완화가 가능합니다. 따라서 궤양 발생의 통일된 개념은 다음과 같습니다. 가을 또는 봄의 불균일한 기간 동안 만성 세균성 위염이 있는 상태에서 소화성 궤양에 걸리기 쉬운 유전적 소인이 있는 환자에서 가스트린, 히스타민, 멜라토닌 및 세로토닌을 분비하는 내분비 세포의 증식 및 과기능만 관찰됩니다. 인간필러십이지장대에서 생성되는 주요 호르몬과 생체 아민은 주로 이 영역에서 위 분비를 자극하고 영양과 세포 증식을 변화시키는 데 관여합니다. 활동성 세균성 위염 및 십이지장염의 배경에 대해 궤양 형성에 유리한 조건이 발생합니다. 소화 불량이 형성되면 내분비 세포의 기능적 활성이 감소합니다. 이것은 산성 소화성 침략의 감소, anthropyloroduodenal zone의 조직 영양 개선 및 HP의 지속적인 미생물 확장의 배경에도 불구하고 위 및 십이지장 궤양의 치유를위한 조건의 생성으로 이어집니다. 소화성 궤양의 급성기에는 보편적인 세포 보호제인 α-엔돌핀 생성 세포의 증식이 관찰됩니다. 그들은 소화성 궤양의 주요 보호 메커니즘으로 작용하고 직접적으로 그리고 면역계를 자극함으로써 궤양과 치유의 자가 제한 과정을 제공합니다. 동시에 위와 십이지장의 점막하층에서 합성된 HP에 대한 항체는 박테리아 세포에 효과적으로 결합하여 HP 독소를 중화시켜 박테리아의 죽음에 기여합니다. 위의 모든 것은 소위 침략 요인과 보호 요인 사이의 균형과 위 십이지장 구역의 소화 결함 치유에 기여합니다. 분류. 분류 (Panfilov Yu.A., Osadchuk M.A., 1991) 소화 불량의 국소화: 1) 위궤양(심장하 및 심장 섹션, 유문 부분 및 유문관, 더 작거나 더 큰 곡률); 2) 십이지장 궤양(전구 및 구후 부분); 3) 위와 십이지장의 궤양. 소화성 궤양의 과정. 1. 쉽다. 궤양의 악화는 1-1년에 3회를 넘지 않으며, 소화성 결손의 치유는 치료 시작 후 5-6주에 끝납니다. 통증 및 소화 불량 증후군의 중증도는 중등도입니다. 2. 보통. 2년에 7회 이상 재발, 궤양 상피화 - 12-XNUMX주 이내에 통증 및 소화불량 증후군의 중증도. 3. 무겁다. 완화 기간은 3-4개월을 초과하지 않습니다. 심한 통증 외에도 합병증이 있습니다. 질병의 단계: 1) 위십이지장계의 궤양 재발 또는 기능 장애의 악화; 2) 완전한 관해(임상, 방사선, 내시경 및 기능적 측면에서); 3) 불완전 (위 십이지장 구역의 기능적 또는 구조적 장애의 보존 포함). 위와 십이지장의 점막 상태: 1) 만성 위염; 2) 만성 십이지장염. 위 십이지장 시스템의 기능 상태 분비: 정상, 증가, 감소. 운동성: 정상, 가속, 느림; 대피: 정상, 가속, 지연, 십이지장 정체. 합병증: 출혈, 천공, 침투, 위염, 십이지장 주위염, 위 및 십이지장의 반흔 기형. 임상 사진. 소화성 궤양의 임상상은 다형성입니다. 증상은 환자의 성별과 나이, 연중 시기, 궤양의 위치와 크기, 환자의 개인적, 사회적 특성, 직업적 자질에 따라 달라집니다. 클리닉은 발병 순간부터 질병의 만성 경과, 질병의 악화 및 완화 징후의 존재, 위 및 십이지장 점막의 결함 치유와 같은 징후의 조합에 의해 결정됩니다. 흉터. 소화성 궤양은 위궤양과 십이지장 궤양의 두 가지 임상 및 형태학적 변이로 나타납니다. 전통적으로 통증과 소화 불량 증후군은 구별됩니다. 주요 임상 징후는 상복부 통증입니다. 통증 증후군의 특성상 만성 세균성 위염과 소화성 궤양을 구별하는 것은 거의 불가능합니다. 주로 봄과 가을에 공복에 상복부 부위의 통증은 소화성 궤양과 만성 세균성 위염 모두에서 똑같이 흔합니다. 만성 세균성 위염과 소화성 궤양 모두에서 음식과 제산제로 통증 증후군을 완화할 수 있습니다. 십이지장 궤양의 특징은 밤에 상복부 부위에 통증이 있다는 것입니다. 소화성 궤양을 동반한 구토는 드뭅니다. 메스꺼움은 위궤양과 십이지장궤양에서 훨씬 더 흔합니다. 변비는 만성 십이지장 궤양을 동반합니다. 소화성 궤양 질환의 증상은 궤양성 결손의 수와 위치에 따라 결정됩니다. 다발성 위궤양은 남성에서 3배 더 흔합니다. 이 경우의 임상상은 소화 결함의 국소화에 달려 있습니다. 위의 몸에 궤양이 있으면 식후 20-30 분에 발생하는 조사없이 상복부에 둔한 통증과 메스꺼움이 나타납니다. 심장하 부위의 궤양으로 흉곽의 왼쪽 절반으로 방사되는 xiphoid 과정 아래 둔한 통증이 특징적입니다. 복합 위궤양과 십이지장 궤양은 활동성 위궤양과 치유된 십이지장 궤양의 조합입니다. 그들은 통증 증후군의 장기간 보존, 질병의 지속적인 경과, 질병의 빈번한 재발, 궤양의 느린 흉터 및 빈번한 합병증이 특징입니다. 구외궤양에는 구십이지장 괄약근 부위와 그 말단에 위치한 궤양이 포함됩니다. 그들의 임상상은 고유 한 특징이 있으며 십이지장 궤양과 공통점이 많습니다. 주로 40~60대 환자에서 발생합니다. 구후 궤양은 심각하고 빈번한 악화와 대량 출혈을 동반하는 경향이 있습니다. 등 또는 오른쪽 견갑골 아래로 방사되는 복부의 오른쪽 상부 사분면에 국한된 통증은 100%의 경우에 발생합니다. 마약 성 진통제를 복용 한 후에 만 진화되는 통증의 강도, 중증도는 환자를 심한 신경 쇠약증으로 만듭니다. 구진 외 궤양의 악화 계절성은 환자의 거의 90%에서 기록됩니다. 많은 환자에서 위장 출혈이 주요 증상이 됩니다. 유문관의 궤양은 유문 증후군이라고 하는 복합 증상을 특징으로 합니다: 상복부 통증, 메스꺼움, 구토 및 상당한 체중 감소. 질병의 악화는 매우 길다. 집중 항궤양 요법의 배경에 대해, 궤양은 3개월 이내에 흉터를 남깁니다. 유문관으로의 풍부한 혈액 공급은 대량의 위 출혈을 일으킵니다. 진단. 소화성 궤양의 복잡하지 않은 과정에서는 일반 혈액 검사에 변화가 없으며 ESR이 약간 감소하고 약간의 적혈구 증가가 가능합니다. 혈액 검사에서 합병증이 발생하면 빈혈, 백혈구 증가증이 나타납니다. 복막이 병리학 적 과정에 관여하는 경우입니다. 소변의 일반적인 분석에는 변화가 없습니다. 복잡한 소화성 궤양의 경우 혈액의 생화학 적 분석에서 시알 검사, C 반응성 단백질, DPA 반응의 매개 변수 변경이 가능합니다. 위장 병리학의 전통적인 연구 방법은 위 내용물의 산도를 결정하는 것입니다. 다양한 지표가 가능합니다. 상승 및 정상, 경우에 따라 감소. 십이지장 궤양은 위액의 산성도가 높으면 발생합니다. X 선 검사에서 소화성 궤양은 바륨 현탁액의 창고 인 "틈새"입니다. 이러한 직접적인 방사선학적 증상 외에도 소화기 결함의 간접적인 징후가 진단에 중요합니다: 공복시 위 내용물의 과분비, 대피 장애, 십이지장 역류, 심장 기능 장애, 국소 경련, 점막 수렴 주름, 위와 십이지장의 반흔 기형. 생검을 동반한 위 십이지장 내시경은 소화성 궤양을 진단하는 가장 신뢰할 수 있는 방법입니다. 이를 통해 궤양 가장자리, 궤양 주위 영역의 점막 변화 특성을 평가할 수 있으며 형태학적 수준에서 진단의 정확성을 보장합니다. 내시경 및 형태 학적 연구에서 대부분의 위궤양은 더 적은 곡률과 전두엽의 영역에 위치하며 훨씬 적은 빈도로 더 큰 곡률과 유문관 영역에 위치하는 것으로 나타났습니다. 십이지장 궤양의 90%는 구근 부위에 있습니다. 소화성 궤양은 일반적으로 모양이 둥글거나 타원형입니다. 바닥은 괴사 성 덩어리로 구성되어 있으며 그 아래에는 육아 조직이 있습니다. 바닥에 검은 반점이 있으면 출혈을 나타냅니다. 궤양 치유 단계는 점막 충혈의 감소와 궤양 주위 영역의 염증 샤프트가 특징입니다. 결함은 덜 깊어지고 섬유소 플라크가 점차 제거됩니다. 흉터는 벽의 선형 또는 별 모양의 수축이있는 점막의 충혈 영역처럼 보입니다. 미래에는 이전 궤양 부위에서 내시경 검사를하는 동안 변형, 흉터, 협착과 같은 점막 완화에 대한 다양한 위반이 결정됩니다. 내시경 검사에서 결함이 육아 조직으로 대체되어 성숙한 흉터는 희끄무레 한 모양을 가지며 활동성 염증의 징후는 없습니다. 궤양의 바닥과 가장자리에서 얻은 생검 표본의 형태학적 연구는 썩어가는 백혈구, 적혈구 및 아래에 위치한 콜라겐 섬유가 있는 박리된 상피 세포의 혼합물과 함께 점액 축적 형태의 세포 찌꺼기를 드러냅니다. 차동 진단. 내시경 검사가 널리 사용됨에 따라 위와 십이지장 궤양(증상이 있는 궤양, 결핵의 특정 궤양, 매독, 크론병, 원발성 궤양암, 이차성 악성 궤양)의 감별진단이 특히 중요해지고 있습니다. 증상이 있는 궤양의 경우 원인이 있어야 합니다(극도의 노출, 내분비 질환의 임상 및 형태학적 징후, 심혈관 및 호흡기 질환, 류마티스 질환). 소화성 궤양 이상으로 병변의 다양성, 위장의 우세한 국소화 및 상당한 크기가 특징입니다. 소화성 궤양의 경우 통증 증후군이 우세하고 만성 위염의 경우 소화 불량 현상이 발생합니다. 만성 위염에서 통증은 경미하거나 없으며 질병의 계절성이 없으며 촉진시 통증이 제한적입니다. 질병의 악화는 종종 음식의 성질에 달려 있습니다. 위염이 있는 위장의 분비 기능 상태는 다를 수 있습니다. 결정적으로 중요한 것은 위내시경과 위생검으로, 위염의 특징인 점막 변화와 소화성 궤양의 궤양이 감지됩니다. 열공 탈장(HH)은 종종 상복부 통증을 동반합니다. 그러나 이 질환은 소화성궤양과 달리 주로 고령의 환자, 통증과 신체의 위치와의 관계(누운 자세에서 통증이 증가하고 직립 자세에서 약해짐)가 특징입니다. HH의 진단은 X선 검사 결과로 확인됩니다. 만성 담낭염은 오른쪽 hypochondrium과 상복부의 통증이 특징이며 종종 오른쪽 견갑골, 어깨, 오른쪽 아래턱의 각도로 방사됩니다. 무결석 담낭염의 경우 둔하고 단조롭고 압박적인 성격을 가지며 결석성 담낭염의 경우 산통의 성격을 얻습니다. 메스꺼움, 변비, 헛배 부름이 나타납니다. 지속적인 아열성 상태가 가능합니다. 담관이 장기간 폐쇄되면 황달이 나타날 수 있습니다. 담도계 손상의 진단은 복부초음파, 엑스레이 검사(담낭조영술), 내시경 역행성담췌관조영술(ERCP), 그리고 결석이 없는 과정에서만 나타나는 십이지장 초음파 검사 결과를 통해 확인된다. 급성 췌장염 및 만성 통증의 악화에서 통증은 상복부 부위의 왼쪽 절반에 국한되며 대상 포진 특성을 가지며 모든 음식 섭취에 의해 유발됩니다. 기억 상실 - 담도계의 병리학, 알코올 남용, 췌장 약물의 장기간 사용. 객관적으로 체중 감소, 다변성, 지방변, 생성기를 드러냅니다. 진단은 췌장 효소, 대변 - 소화율 및 도구 데이터에 대한 생화학 적 혈액 검사 결과로 확인됩니다. 치료. 소화성 궤양에 대한 합리적인 치료법에는 요법, 적절한 영양, 약물 치료, 심리 치료, 물리 치료 및 스파 치료 방법이 포함되어야 합니다. 소화성 궤양 질환이 악화되는 기간에는 분할식이 요법 (특정 시간에 음식의 각 부분을 소량 섭취하여 하루 4 ~ 6 회)을 엄격히 준수해야합니다. 식품은 완충 특성이 좋아야 하며 충분한 양의 단백질(120-140g)을 함유해야 합니다. 정신 요법은 지속적인 통증 증후군과 그 기대로 인해 발생하는 정신 신경 반응을 멈추거나 줄이는 데 필수적입니다. 소화성 궤양 치료에 사용되는 의약품은 5가지 그룹으로 나뉩니다. 1) 위산-소화 인자에 영향을 미치는 약물(제산제 및 H2히스타민 차단제, 기타 항분비제); 2) 위 점막 장벽을 개선하는 약물; 3) 내인성 프로스타글란딘의 합성을 증가시키는 약물; 4) 항균 및 방부제; 5) 위와 십이지장의 운동 대피 장애를 정상화하는 약물. 제산제: 1) 용해성 (흡수성) - 소다, 탄산 칼슘 (분필) 및 산화 마그네슘 (탄 마그네시아)의 중탄산염; 2) 불용성(비흡수성): 삼규산마그네슘 및 수산화알루미늄. 수용성 제산제는 빠르고 강력하지만 단기적인 알칼리화 효과가 있지만 종종 부작용을 유발하므로 소화성 궤양 치료에 사용되지 않습니다. 수산화알루미늄과 수산화마그네슘(Almagel, Phosphalugel, Gelusillac, Topaal, Maalox 등)을 기반으로 한 불용성 제산제는 염산을 장기간 중화시키고 점막을 감싸 산과 음식의 손상 효과로부터 보호합니다. 염산을 중화시키는 것 외에도 위액의 단백질 분해 활성을 감소시키고 라이소레시틴과 담즙산을 결합시키며 보편적인 세포 보호 효과를 나타냅니다. 제산제는 식후 1-2시간과 저녁에 복용해야 합니다. Maalox는 현탁액(15일 4회 1ml) 또는 정제(2일 4회 16-3정), 포스파루겔-겔 형태(4일 XNUMX-XNUMX회 XNUMXg)로 처방됩니다. 비흡수성 제산제의 주요 부작용 중 하나는 대변 장애입니다. 수산화알루미늄 제제는 변비를 유발하고 수산화마그네슘 제제(말록스)는 용량 의존적 완하제 효과가 있습니다. H의 출현으로 소화성 궤양 치료의 새로운 시대가 열렸습니다.2- 히스타민 차단제. 생리학적 조건에서 히스타민은 산 생성을 유발하는 위외 신경과 체액 자극을 매개합니다. 히스타민에 의한 염산 생성 촉진은 위의 산 생성 부위에 함유된 효소 아데닐시클라아제에 작용하여 수소 이온의 분비를 증가시키는 cAMP의 활성 증가에 기인한다. 얻은 데이터는 cimetidine, ranitidine, famotidine, nizatidine 등과 같은 세포 수준에서 분비 과정에서 히스타민의 참여를 방해하는 약물 합성의 기초였습니다. 또한 H 길항제2히스타민 수용체는 위 점막의 미세 순환 장애를 예방하여 궤양의 발병을 예방합니다. 또한 펩신 생성을 감소시키고 중탄산염 분비를 증가시키며 위십이지장 운동을 정상화하고 DNA 합성 상피 세포의 수를 증가시키며 회복 과정을 자극하고 만성 위 및 십이지장 궤양의 치유를 가속화합니다. 그러나 1세대 약물(시메티딘, 시나메트, 벨로메트, 타가메트)은 신경계의 변화, 독성 간염, 심혈관계의 리듬 및 전도 장애, 조혈 기관의 변화를 일으킬 수 있습니다. H 차단제2히스타민 수용체의 후속 세대 - ranitidine (zantak, ranisan, gistak), famotidine (kvamatel, lecedil, gastrosidin), nizatidine (roxatidine)은 좋은 내성에서 시메티딘과 다릅니다. 라니티딘은 150일 2회 20mg, 파모티딘(famotidine)은 2-4주 동안 6일 150회 20mg으로 처방됩니다. 궤양 치유 후 금단 증후군을 예방하기 위해 라니티딘(2mg) 또는 파모티딘(3mg)을 밤에 XNUMX-XNUMX개월간 계속 복용하는 것이 좋습니다. 최근에는 벤지미다졸 유도체에 속하는 새로운 항분비제인 오메프라졸(omenrol, omez,losk)이 등장했다. 그것은 정수리 세포의 양성자 펌프의 효소 H + -K + -ATPase를 차단합니다. 짧은 반감기(약 1시간)와 긴 작용 지속시간(18-24시간)으로 이 약을 한 번 복용할 수 있습니다. Omeprazole은 20-1주 동안 2일 3회 밤에 XNUMXmg을 처방합니다. 오메프라졸은 현대의 항궤양제 중 항분비 효과의 정도 면에서 XNUMX위를 차지하며 약물의 부작용이 그다지 두드러지지 않습니다. 소화성 궤양 치료에 널리 사용되면서 항콜린제에 속하는 가스트로세핀(니렌제핀, 가스트로제핀)이 발견되었습니다. 이 약물은 염산과 펩신을 생성하는 위 점막 세포에 위치한 무스카린성 아세틸콜린 수용체를 선택적으로 차단합니다. Gastrocepin은 기저 및 자극된 위 분비에 대한 억제 효과가 있으며, 펩신의 생성을 억제하고, 위로부터의 배출을 늦추고, 가스트린 생성을 억제하고, 췌장 폴리펩타이드의 수준을 감소시키고, 위 점액 당단백질의 생성을 증가시켜 세포 보호 효과가 있습니다. 뿐만 아니라 위 십이지장 부위의 점막으로의 혈액 공급을 개선합니다. 식사 50분 전에 하루에 2번 30mg을 할당하십시오. 치료 과정은 평균 4주입니다. 위의 점막 장벽을 강화하는 약물에는 점막에 보호막을 형성하고, 위의 소화 활동을 감소시키고, 펩신과 불용성 화합물을 형성하고, 점액 형성을 강화하고, 세포 보호 효과가 있는 콜로이드성 비스무트(데놀) 제제가 포함됩니다. 효과, 위벽의 프로스타글란딘 함량을 증가시킵니다. 데놀은 위점막에서 HP의 활동을 억제하는 능력이 있습니다. 이 약은 식전 2분 또는 식후 240시간에 2정(2mg)을 하루 8회 처방합니다. 비스무트 염이 체내에 축적되는 것을 방지하려면 XNUMX주 이상 이러한 약물로 치료를 수행하지 않는 것이 좋습니다. 위궤양과 십이지장궤양의 항균치료를 위해 테트라사이클린, 아목시실린, 클라리스로마이신 등이 사용된다. 이들은 다른 항궤양제와 함께 사용됩니다. 여러 조합 요법(XNUMX, XNUMX, XNUMX성분)이 제안되었습니다. 1000성분 요법: 아목시실린 2mg을 2주 동안 하루에 40번; 오메프라졸 2mg을 하루에 두 번. 120 구성 요소 계획에는 하루에 4 번 콜로이드 비스무트 250mg 준비가 포함됩니다. 테트라사이클린 4mg 하루 250회; 메트로니다졸 4mg을 하루 14번. 치료 주기는 XNUMX일입니다. 20 성분 계획에는 2 일에서 1 일까지 하루에 10 번 오메프라졸 120 mg이 포함됩니다. de-nol 4 mg을 4일부터 10일까지 하루에 500번; 4 일에서 4 일까지 하루에 10 번 테트라 사이클린 500 mg; 3일부터 4일까지 메트로니다졸 10mg을 6일 93회 투여합니다. 위와 십이지장의 소화성 궤양 치료를위한 96 가지 구성 요소가 가장 효과적인 것으로 인식됩니다. XNUMX주 후, 환자의 XNUMX-XNUMX%에서 소화기 결손의 치유가 관찰됩니다. 위와 십이지장의 소화성 궤양의 흉터 후, 전통적으로 두 가지 유형의 치료가 사용됩니다. 1) 항분비제를 XNUMX일 용량의 절반으로 하여 최대 XNUMX년 동안 지속 유지 요법을 시행합니다. 2) "요청 시" 요법은 소화성 궤양의 증상이 나타날 때 XNUMX주 동안 항분비제 중 하나를 일일 용량의 절반으로 사용하는 것을 포함합니다. 예후 및 예방. 합병증이 없는 형태의 질병은 삶과 일에 있어 유리한 예후를 보입니다. 소화성 궤양 질환의 합병증의 경우 수술 치료의 적시성에 따라 예후가 결정됩니다. 소화성 궤양 재발 예방에는 2년에 3번 의사의 의무적인 추적 검사와 함께 동적 모니터링이 포함됩니다. 검사에는 임상 및 내시경 검사가 포함되어야 하며, 필요한 경우 형태학적 검사가 포함되어야 합니다. 예방 조치로 수면과 휴식을 정상화하고 나쁜 습관을 포기하고 궤양 성 약물 섭취를 제한하고 하루 XNUMX끼 합리적으로 식사하고 XNUMX 개월마다 일주일 동안 XNUMX ~ XNUMX 성분 요법을 사용하는 것이 좋습니다. 강의 12. 소화관의 질병. 장의 질병. 소장의 질병. 만성 장염 만성 장염은 소장의 점막의 염증, 위축 및 경화증의 발달로 절정에 이르는 영양 장애 및 재생 장애 변화의 배경에 대한 기능 (소화 및 흡수)의 위반을 특징으로하는 소장의 질병입니다. 병인학 및 병인. 이는 소장의 급성 염증 또는 일차 만성 과정의 결과일 수 있는 다병인성 질환입니다. 최근 몇 년 동안 Yersinia, Helicobacteria, Proteus, Pseudomonas aeruginosa, rotaviruses, 원생동물 및 기생충(giardia, ascaris, 촌충, opisthorchia, cryptosporidium)의 수많은 대표자들이 만성 장염의 병인학적 인자로서 매우 중요해졌습니다. 만성 장염의 발생에서 가장 중요한 것은 과식, 건조 식품 섭취, 불균형, 주로 탄수화물 식품, 향신료 남용과 같은 소화기 요인입니다. 장염은 전리 방사선, 독성 물질 노출 및 약물에 의해 발생합니다. 소장의 만성 질환의 일반적인 병인 메커니즘 중 국소 및 일반 면역 감소를 배경으로 장내 미생물총의 변화가 있습니다. 면역 상태의 변화 - 분비 IgA 함량 감소, IgE 수준 증가, 림프구의 아세포 변형 감소 및 백혈구 이동 억제 - 기회주의 미생물 및 정상적인 혐기성 식물군의 감소. 소장의 세균 군집화는 상피세포 cAMP의 활성화로 인한 장분비를 증가시키며, 이는 장 투과성을 증가시키고 세포에 의한 전해질 및 수분 생성을 증가시킨다. 물과 전해질의 분비는 물 - 소금 대사를 위반합니다. 미생물 군집의 영향으로 담즙의 장간 순환이 방해받습니다. 지방산은 칼슘 이온과 결합하여 대변으로 배설되는 난용성 비누를 형성합니다. 칼슘 대사의 위반은 칼슘의 흡수를 감소시키는 비타민 D의 대사 변화에 의해 촉진됩니다. 지용성 비타민의 대사 장애의 영향으로 혈액의 미량 원소 함량이 감소합니다. 장기간의 dysbiosis는 미생물 및 식품 항원에 대한 감작을 촉진하고 점막의 면역 염증을 일으켜 조직 항원을 형성합니다. 점액 장벽의 증가된 투과성은 알레르겐이 되고 면역학적 반응성이 손상되는 비분할 단백질 거대분자의 흡수를 동반합니다. 알레르기가 있으면 장벽의 투과성을 증가시키고 장 세포의 기능적 특성을 변화시키는 생물학적 활성 물질이 방출됩니다. 장 세포 세포질 막의 미세 구조 위반은 먼저 락타아제 활성을 억제 한 다음 말타아제 및 수크라아제 활성을 억제합니다. 상피 세포의 영양 장애, 재생 장애 변화로 인해 상피 세포의 막에 대한 효소 합성 및 흡착 - 이당류, 펩티다아제, 엔테로 키나아제, 알칼리성 인산 가수 분해 효소 -가 감소하여 막 및 공동 소화에 장애를 일으 킵니다. 이 모든 것이 흡수 장애 증후군의 기초가 됩니다. 질병의 초기 단계에서 지방 흡수의 감소, 대변으로의 손실 및 장간 담즙 순환의 장 단계 변화로 인해 지질 대사 장애가 발생합니다. 담즙 대사의 위반은 차례로 세포막의 구조와 기능에 영향을 미치는 지질 대사의 위반으로 이어집니다. 불충분 한 지방 흡수와 관련하여 스테로이드 합성에 대한 위반이 발생하여 내분비선의 기능을 침해합니다. 형태학적으로 만성 장염은 소장 점막의 염증성 및 퇴행성 변화로 나타납니다. 과정이 진행되면 위축과 경화가 관찰됩니다. 분류 (Zlatkina A.R., Frolkis A.V., 1985). 1) 병인학: 장 감염, 기생충 침입, 소화기, 물리화학적 요인, 위, 췌장, 담도 질환. 2) 질병의 단계: 악화; 용서. 3) 중증도: 경증; 보통의; 무거운. 4) 현재: 단조로운; 재발; 지속적으로 반복되는; 숨어있는. 5) 형태적 변화의 특징: 위축이 없는 단위체; 중등도의 부분 융모 위축이 있는 황막염; 부분 융모 위축을 동반한 황막염; 전체 융모 위축이 있는 유니트. 6) 기능 장애의 성격: 막 소화 장애(이당류 결핍증), 수분 흡수 장애, 전해질, 미량 원소, 비타민, 단백질, 지방, 탄수화물. 7) 합병증: 일광염, 비특이적 중절염. 임상 사진. 만성 장염의 임상 양상은 국소 및 일반 장 증후군으로 구성됩니다. 첫 번째는 정수리(막) 및 공동 소화(소화 불량) 과정을 위반하여 발생합니다. 환자들은 고창, 배꼽주위 부위의 통증, 모자 모양의 팽만감, 큰 소리, 설사, 그리고 덜 흔하게는 변비를 호소합니다. 촉진은 중위부뿐만 아니라 배꼽 왼쪽 및 위(양성 Porges 징후)에 통증을 나타내며 맹장 부위에 튀는 소음(Obraztsov 징후)을 나타냅니다. 대변은 점토질의 외관을 가지며, 다중 대변 물질이 특징적입니다. 일반 장 증후군은 식품 성분의 흡수 장애(흡수 장애)와 관련되어 모든 유형의 신진 대사 장애, 항상성 변화를 유발합니다. 다면적 대사 장애, 주로 단백질로 특징지어지며 점진적인 체중 감소로 나타납니다. 탄수화물 대사의 변화는 덜 두드러지며, 이는 유제품을 섭취하는 동안 팽만감, 복부의 울렁거림 및 설사 증가로 나타납니다. 대부분 환자의 체중 결핍은 단백질뿐만 아니라 지질 불균형으로 인한 것입니다. 지질 대사의 변화는 지용성 비타민과 미네랄(칼슘, 마그네슘, 인)의 대사 장애와 밀접한 관련이 있습니다. 칼슘 결핍의 특징적인 징후는 근육 롤러, 경련, 재발성 "동기가 없는" 골절, 골다공증, 골연화증의 긍정적인 증상입니다. 또한 얼굴의 붓기, 입술의 청색증, 설염, 과민성, 수면 부족이 있습니다. 수분 및 전해질 균형의 위반은 전반적인 약화, 신체 활동 부족, 근육 저혈압, 메스꺼움, 구토 및 중추 신경계의 변화로 나타납니다. 비타민 다발증의 증상은 중등도 및 중증도의 만성 장염에 전형적이 됩니다. 비타민 C Hypovitaminosis는 잇몸 출혈, 반복되는 코, 자궁 출혈, 피부 타박상으로 임상 적으로 나타납니다. 비타민 Hypovitaminosis B는 피부의 창백, 설염, 각성 구내염(cheilez)을 동반합니다. 지용성 비타민(A, O, E, K) 결핍 징후: 황혼의 시력 저하, 피부 및 점막 건조, 잇몸 출혈 증가. 심각한 형태의 만성 장염은 내분비 기능 장애(다선샘 기능 부전)의 증상과 함께 발생합니다. 부신피질기능저하증은 동맥저혈압, 심장부정맥, 식욕부진, 피부색소침착으로 나타난다. 생식선의 활동 감소는 난소 기능 장애, 월경 장애, 남성의 발기 부전, 여성형 유방, 탈모를 동반합니다. 갑상선 기능 장애는 전반적인 쇠약, 건조한 피부, 서맥, 성능 저하 및 지적 기억 기억 장애를 특징으로 합니다. 진단 및 감별진단. 일반적인 혈액 검사에서는 미세 및 대적혈구 빈혈, ESR 증가, 심한 경우에는 림프 및 호산구 감소증이 나타납니다. 질병이 기생충에 의한 것이라면 혈액에서 림프구 증가증과 호산구 증가증이 관찰될 수 있습니다. scatological 검사는 지방산과 비누로 인한 장 유형의 지방변, 생성기, 아밀로르를 나타냅니다. 대변에서 enterokinase와 알칼리성 인산 가수분해 효소의 함량이 증가합니다. 대변의 일일 질량이 크게 증가합니다. 대변의 세균학적 분석은 다양한 정도의 dysbacteriosis를 나타냅니다. 유산균 및 비피더스균, 장구균이 감소하고 효소 특성이 변경된 대장균 균주가 나타납니다. 심한 형태의 만성 장염에서 소변의 일반적인 분석에서 미세 단백뇨 및 미그로 혈뇨가 주목됩니다. 생화학 적 혈액 검사에서 저단백 혈증, 저 알부민 혈증, 저 글로불린 혈증, 저칼슘 혈증, 마그네슘, 인 및 기타 미량 요소 수준의 감소, 나트륨 및 칼륨 수준의 감소 형태의 전해질 대사 장애가 감지됩니다. 지질 대사 장애는 지질 스펙트럼의 변화를 동반합니다. 콜레스테롤, 인지질 수치가 감소하고 담즙산, 인지질 및 트리글리세리드의 스펙트럼도 변경됩니다. 엑스레이 연구의 결과는 소장의 운동 기능과 점막의 완화, 황산 바륨 현탁액의 통과 속도가 느려지거나 가속되는 형태의 근긴장 이상 및 운동 이상 변화를 명확히 할 수 있습니다. 장 및 점막의 완화가 주름의 고르지 않은 두꺼워짐, 변형 및 평활화의 형태로 바뀝니다. 위 십이지장 내시경은 위축성 위염과 십이지장염을 나타냅니다. 경미한 형태의 만성 장염의 형태 학적 그림은 융모의 두꺼워짐, 변형, 노치 깊이의 감소, 평활근의 색조 감소, 상피 부종, 상피 표면의 퇴행성 변화가 특징입니다 , 세포의 브러시 경계의 얇아짐, 융모 부위의 잔 세포 수의 감소, 선와 수의 증가, 림프 형질 세포 요소가있는 자체 층 점막의 침윤, 해당 지역의 Paneth 세포 감소 지하실의 바닥. 중등도의 경우 융모의 부분 위축, 선와 수의 감소, 점막의 얇아짐, 브러시 경계의 감소, 점막하층 및 근육층의 림프질세포 침윤이 전형적입니다. 질병의 심각한 형태는 조직학적, 조직화학적 및 형태학적 기준에 의해 진단되는 진행성 융모 위축을 특징으로 합니다. 장세포의 증식 과정은 분화보다 우세하며 미성숙하고 결함이있는 세포가 많이 나타납니다. 만성장염의 감별진단은 체강장병증, 크론병, 휘플병, 장아밀로이드증, 게실병, 림프종, 소장종양 등으로 이루어진다. 이러한 모든 상태에 공통적인 것은 소화 불량, 흡수 및 세균 이상증의 임상 증후군입니다. 최종 진단은 소장 점막의 형태학적 검사로 확인합니다. 따라서 체강 장 병증의 경우 글리아딘 함유 제품의 사용과 질병 악화의 관계에 대한 기억 상실 징후가 일반적입니다. 체강 장병증의 클리닉은 만성 장염과 유사합니다. 대부분의 경우 상부 장이 영향을 받고 회장에는 변화가 없습니다. 생검 표본을 채취하기 위한 최적의 부위는 Treitz 인대 근처의 점막 부위입니다. 형태 학적 검사는 잔 세포 수의 감소와 상피 간 림프구 수의 증가, 융모 부분 위축 및 자체 층의 염증 세포 침윤을 나타냅니다. 체강 장병증의 경우 형태학적 변화가 되돌릴 수 없는 진부한 만성 장염과 달리 글루텐이 없는 식단의 배경에 대한 형태학적 변화가 가역적입니다. 크론병에서는 질병의 자가면역 기원과 특징적인 전신 증상(예: 자가면역 갑상선염, 다발성 관절염, 홍채염, 간염, 장염과 원위 대장염의 빈번한 조합)으로 인해 임상적 다형성이 나타납니다. 내시경 및 형태학적 검사는 크론병의 검증에 고해상도를 제공하여 장 병변의 모자이크 특성, 손상되지 않은 점막 부위와 번갈아 나타나는 "조약돌 포장" 유형의 전형적인 변화를 나타냅니다. 엑스레이, 내시경 검사로 장 협착을 감지할 수 있으며 때로는 장 누공이 형성됩니다. 형태학적 진단은 점막하층에 대한 최대의 손상과 점막의 최소한의 변화로 장벽의 모든 층의 염증 세포 침윤을 나타냅니다. 점막하층에서 이 질환의 특징인 림프구 유육종 유사 육아종이 발견됩니다. 휘플병은 장염의 징후와 더불어 발열, 관절염, 림프절병증, 동맥 저혈압, 피부 색소 침착 등의 장외 증상이 특징입니다. 질병의 가장 유익한 형태학적 기준. 소장에서 채취한 생검은 소장 점막과 장간막 림프절에서 세포 내 및 세포 외 지방 축적을 나타냅니다. CHIC 양성 무지방 과립을 포함하는 큰 마이크로파지에 의한 자체 층의 침윤 및 점막의 간균 존재. 치료. 만성 장염의 치료는 병인 요인, 병인 기전은 물론 질병의 국소 및 일반 증상에 영향을 미치는 약제를 포함하여 포괄적이어야 합니다. 기본은 장내의 증가 된 삼투압을 줄이고 분비를 줄이며 장 내용물의 통과를 정상화하는 데 도움이되는식이 영양입니다. 거친 식물성 섬유가 포함된 제품(생야채, 과일, 호밀 빵, 견과류, 패스트리, 통조림 식품, 향신료, 매운 요리, 전유, 맥주, 크바스, 탄산 및 알코올 음료)은 제외합니다. 식탁용 소금의 사용은 제한적입니다. 하루에 최대 5-6 번 부분 식사가 필요합니다. 완화 기간 동안 일부 야채와 과일은 하루에 최대 100-200g까지식이 요법에 도입됩니다. 양상추, 잘 익은 껍질을 벗긴 토마토, 부드러운 배, 달콤한 사과, 오렌지, 귤, 라즈베리, 딸기, 야생 딸기를 지정하십시오. 음식은 삶거나 쪄야 합니다. 약물 치료는 병인성, 병원성, 대증적이어야 합니다. 이방성 치료: II-IV 등급 세균불균형의 경우 항균제가 처방됩니다: 메트로니다졸(0,5g 3일 0,5회), 클린다마이신(4g 0,5회), 세팔렉신(2g 0,48일 2회).일), 비셉톨( 1g 3일 4회), 설진(0,1g 4일 5~3회), 푸라졸리돈(30g 3일 3회). 항균제를 사용한 후 유바이오틱스가 처방됩니다. 식사 전 40 분에 bifidumbacterin 또는 bificol 3 회 투여, 식사 전 하루 3 회 대장균 또는 유산균 3 회, 식사 전 하루 20 회 hilakforte 3 방울. 박테리아 제제를 사용한 치료는 매년 15개월씩 20코스로 오랫동안 수행됩니다. 포도상 구균 이상균증의 경우 항 포도상 구균 박테리오파지가 처방되고 (20-3 일 동안 하루에 2 번 3ml), 프로테우스 이상균증-대장균 박테리오파지의 경우 XNUMX 일 XNUMX 회 XNUMXml, 치료 과정은 XNUMX-XNUMX 주입니다. 지사제 증상제로 이모디움(로페라미드)을 1일 2~3회 식전에 3~5일간 처방합니다. 소화 과정을 개선하기 위해 효소가 권장됩니다. pancreatin, panzinorm forte, festal, digestal, pankurmen, mezim forte, trienzyme, 복용량은 개별적으로 선택됩니다(1일 3회 3정에서 4일 4회 2-3정 ) 및 XNUMX-XNUMX개월 동안 식사 전 또는 식사 중에 직접 처방됩니다. 필요한 경우 효소 대체 요법을 장기간 계속합니다. 장염 환자의 일반적인 상태를 정상화하고 대사 장애를 제거하기 위해 대체 요법이 표시됩니다. 비타민 결핍을 보충하기 위해 비타민 B와 B는 4-5주 동안 처방됩니다.6 각각 50 mg, PP - 10-30 mg, C - 각각 500 mg. 지방변의 경우 비타민 B의 비경구 투여가 필요합니다.2 (100-200mcg) 지용성 비타민과 함께. 리보플라빈 0,02g, 엽산 0,003g 3300일 2회, 비타민 E 150 IU 200일 250회 처방합니다. 심각한 단백질 결핍으로 발생하는 만성 장염의 경우 식이요법, 혈장의 비경구 투여, 단백질 가수분해물 500-20 ml 및 아미노산 혼합물(아미노펩티드, 알베신, 폴리아민, 인트라푸신, 2,0일 동안 1-7 ml 정맥내) 단백 동화 호르몬 (10-3 주 동안 4-XNUMX 일에 XNUMX 회 retabolil XNUMX ml) 및 지질 내 지방 혼합물과의 조합. 스테로이드의 임명은 상당한 단백질 결핍, 저단백 혈증, 부신 기능 부전의 존재에만 표시됩니다. 수분 및 전해질 장애를 교정하기 위해 등장성 용액 또는 포도당 용액 20-30 ml에 panangin 10-10 ml, 글루콘산칼슘 20-200 ml, 다중이온성 용액 "Disol", "Trisol", "Quartasol"을 정맥 투여합니다. 가리키는. 전해질 용액은 산-염기 상태와 혈액 전해질 수준의 조절하에 400-10일 동안 정맥내 투여됩니다. 예후 및 예방. 대부분의 경우 삶의 예후와 노동 능력은 유리합니다. 예후적으로 불리한 징후는 질병의 지속적인 재발 과정, 급격한 체중 감소, 빈혈, 내분비 장애 증후군(성욕 감소, 월경 곤란, 불임)입니다. 만성 장염의 예방은 급성 장 감염 및 위십이지장 구역의 수반되는 질병의 적시 치료,식이 요법 관찰, 엑스레이 및 방사선 요법 중 세균 제제의 예방 투여로 구성됩니다. 강의 13. 소화관의 질병. 장의 질병. 크론병 크론병은 전신 증상이 있는 만성 장 질환입니다. 형태 학적 기초는 위장관의 육아종자가 면역 염증입니다. 병인학 및 병인. 질병의 병인 및 발병 기전은 충분히 연구되지 않았습니다. 가장 인기있는 것은 질병 발생에 대한 전염성 및 면역 개념입니다. 최근 몇 년 동안 예르시니아(Yersinia) 속의 미생물의 병인학적 역할에 대한 보고가 나타났습니다. 그러나 이러한 미생물 제제가 병원균인지 공생균인지를 판단하는 것은 어렵습니다. 동시에, 장내 미생물의 변화는 질병의 발병에 중요한 역할을 합니다. 일반적으로 병원성의 징후와 함께 장내 세균의 증가와 함께 비피덤 유형 세균의 감소. 자가면역 기전은 질병의 발병에 중요한 역할을 합니다. 크론병에서 자가항체(IgC, IgM)는 장 조직에 대해 나타납니다. 질병의 형태학적 기질은 초기에 점막하층에서 발생하는 자가면역 염증 과정이며 장벽의 전체 두께로 퍼지며 육아종성 침윤물의 존재에 이어 점막의 궤양, 농양의 발달이 특징입니다. 흉터의 형성과 장 내강의 협착으로 치유되는 누공. 질병의 지속 기간이 증가함에 따라 병변의 정도가 증가하고 장외 장애의 증상이 나타납니다. 분류. 분류 (F.I. Komarov, A.I. Kazanov, 1992). 1) 코스: 급성; 만성병 환자. 2) 과정의 특징: 소장 내 병변; 회맹 영역 내의 병변; 결장 내 병변. 3) 합병증: 장의 협착; 결장의 독성 팽창; 누공; 아밀로이드증; 신결석, 담석증; 에12- 결핍성 빈혈. 임상 사진. 크론병의 임상상은 장의 병리학적 과정의 국소화 및 정도, 질병의 형태 및 합병증의 추가에 따라 결정되는 상당한 다양성을 특징으로 합니다. 질병의 발병은 질병이 초기부터 진행되는 급성 및 질병이 점진적으로 시작되는 만성일 수 있습니다. 첫 번째 경우, 진단은 종종 맹장염이 의심되는 개복술 또는 젊은 사람들에게 뚜렷한 이유 없이 발생한 장폐색에 대해 수행됩니다. 동시에 소장의 충혈 부위, 크론병의 특징인 장간막 뿌리의 비대해진 림프절이 발견됩니다. 환자는 특정 국소화없이 복부 통증, 눈에 띄는 병리학 적 불순물없이 대변이 느슨해짐, 체중 감소, 낮은 체온에 대해 불평합니다. 객관적인 연구는 빈혈의 중증도, 흡수 장애 및 단백질 대사 장애로 인한 다리 부종과 관련된 피부의 창백에 주목합니다. 복부 촉진시 헛배 부름과 덜거덕 거림이 나타납니다. 과정이 대장에 국한되면 설사, 경련성 복통, 혈액이 혼합 된 액체 또는 반 형태의 대변과 함께 변비가 번갈아 나타납니다. 상부 위장관이 영향을 받으면 만성 식도염, 만성 위염, 만성 십이지장염과 유사한 증상이 나타납니다. 음식이 식도를 통과하는 동안 흉골 뒤에 통증이 있을 수 있으며, 상복부의 "배고픈" 통증, 유문 십이지장 구역의 촉진 시 통증이 있을 수 있습니다. 환자의 신체 검사 중에 피부의 창백함, 아열성 상태, 체중 결핍이 결정되고 촉진은 경련성 장 루프, 오른쪽 장골 부위의 배꼽 주위 통증을 나타냅니다. 크론 병에서는 아프타 구내염, 구강의 가래 및 누공, 관절염, 클리닉의 류마티스 관절염과 유사한 작은 관절의 대칭 병변의 특징적인 증상, 아침의 강직과 같은 질병의 장외 징후가 나타납니다. 눈의 전형적인 변화: 홍채염, 홍채모양체염, 황반병증. 피부는 결절 홍반 및 괴저성 농피증을 유발할 수 있습니다. 설사는 대변의 빈도가 하루에 최대 10회 이상 증가하는 것이 특징이며, 다변성 물질입니다. 대변의 양은 과정의 해부학적 국소화에 의해 결정됩니다. 근위 소장이 손상되면 대변의 양이 원위 부분의 손상보다 훨씬 큽니다. 체중 감소는 모든 환자에서 나타납니다. 진단 및 감별진단. 악화 중 임상 혈액 검사를 통해 백혈구 증가증, 빈혈 및 ESR 증가가 나타납니다. 일반적인 소변 분석의 변화는 신장 아밀로이드증(단백뇨)이 추가되는 것을 특징으로 하는 심각한 형태로 나타납니다. 생화학 적 혈액 검사 결과 저단백 혈증, 저 알부민 혈증, α- 글로불린 증가, 철분 함량 감소, 비타민 B12, 엽산, 아연, 마그네슘 및 칼륨. scatological 검사 데이터를 통해 병변의 수준을 간접적으로 평가할 수 있습니다. 과정의 소장 국소화가 있는 공동 프로그램에서 다변성 물질, 지방변, 생성기변이 발견됩니다. 결장 - 점액, 백혈구, 적혈구의 혼합물. X 선 진단을 통해 장의 병리학 적 과정의 국소화 및 보급을 설정할 수 있습니다. 영향을 받은 장의 영역은 변경되지 않은 장의 영역과 번갈아 나타납니다. 변경된 루프는 단단해지고, 그림은 작은 충전 결함이 있는 모자이크이며 주머니 형태로 장벽 너머로 대조가 침투합니다. 영향을받는 지역의 장은 pseudodiverticula의 형성과 함께 미세하게 드리워진 특성을 얻습니다. 장벽의 수축 능력이 감소하거나 완전히 상실되면 바륨 배출이 느려집니다. 장의 내강이 고르지 않게 좁아지는 것이 관찰되어 결과적으로 너무 좁아져 레이스 형태를 취합니다. 협착 영역 위에서 장이 확장됩니다. 내시경 진단은 진단의 검증에 결정적으로 중요합니다. 크론병의 가장 큰 특징은 위의 앞부분과 십이지장의 초기 부분의 변화입니다. 내시경으로 종양 협착증과 유사한 전두엽의 원형 협착을 감지하는 것이 가능합니다. 크론병의 초기 기간은 빈약한 내시경 데이터가 특징입니다. 즉, 무딘 점막에 대해 아프타 유형의 미란이 보이고 희끄무레한 과립으로 둘러싸여 있습니다. 혈관 패턴이 없거나 매끄럽습니다. 장의 내강과 벽에서 화농성 점액이 결정됩니다. 임상적 관해에서는 설명된 변화가 완전히 사라질 수 있습니다. 질병이 진행됨에 따라 점막이 고르지 않게 두꺼워지고 희끄무레한 색을 띠며 큰 표재성 또는 깊은 균열 궤양이 나타납니다. 장의 내강이 좁아져 대장 내시경을 진행하기 어렵습니다. 대장 내시경 검사를 통해 결장의 모든 부분과 회장 말단의 점막에 대한 표적 생검을 수행할 수 있습니다. 크론병은 병리학적 과정이 점막하층에서 시작되기 때문에 점막하층의 일부가 생검 물질로 들어가도록 생검을 시행해야 한다. 위와 관련하여 54%의 경우 질병의 형태학적 기질이 감지되지 않습니다. 크론병은 비특이적 궤양성 대장염, 위장관 결핵, 허혈성 대장염, 휘플병, 게실 질환, 위막성 대장염, 림프육아종증, 원발성 소장 아밀로이드증, 만성 장염과의 감별이 필요하다. 이러한 모든 질병에 공통적으로 나타나는 것은 장내 소화불량 증후군과 일부 전신 병변입니다. 그러나 궤양성 대장염은 결장 말단부의 변화를 특징으로 하며 그 과정에서 직장과 S상 결장이 필수적으로 관여합니다. 비특이적 궤양성 대장염에서는 병변의 분할이 없습니다. 크론 병보다 덜 자주 전신 증상이 결정되고 흡수 장애 증후군이 덜 두드러집니다. 그러나 크론병의 가장 정확한 진단은 표적 생검을 통한 내시경 검사로 확인됩니다. 위장 형태의 결핵은 회장의 빈번한 국소화, 회백색 내용물로 채워진 융기되고 박리된 가장자리가 있는 궤양을 감지할 수 있는 내시경 소견인 내시경 소견에 의해 크론병과 구별됩니다. 이러한 궤양은 크론병에서 관찰되지 않는 짧은 흉터의 형성으로 치유됩니다. 노인에서는 크론병과 허혈성 대장염을 감별할 필요가 있다. 후자의 경우, 식사 후 복부에 심한 통증이 발생하는 것은 비장 굴곡, 하행 결장 및 S상 결장에서 전형적이고 홍채경 검사로 감지할 수 있는 대장염 변화입니다. 허혈성 대장염의 가장 중요한 방사선학적 징후는 "지문" 증상입니다. 내시경 및 형태학적 검사는 생검 물질에서 허혈성 대장염 헤모시데린 함유 세포 및 섬유증에 대한 전형적인 것을 보여줍니다. 림프육아종증과 원발성 장 아밀로이드증의 진단은 조직학적 검사를 기반으로 합니다. 첫 번째 경우에는 Berezovsky-Sternberg 세포가 장간막 림프절의 생검 표본에서 발견되고 두 번째 경우에는 직장 점막에 아밀로이드 침착물이 있습니다. 치료. 단백질, 비타민, 미량 원소 함량이 높은 기계적, 화학적으로 부드러운 식단이 처방되며, 우유가 견딜 수 없는 경우 우유는 제외되고 거친 식물 섬유는 제한됩니다. 액체 장내 가수분해물의 사용이 표시됩니다. Salazopreparations와 코르티코스테로이드는 병원성 약물 치료의 기초를 형성합니다. 약물의 일일 복용량은 3-6g이며 대장의 병리학 적 과정이 국소화됨에 따라 설파살라진의 활성이 프레드니솔론의 활성을 초과합니다. sulfasalazine 사용의 효과가없고 소장의 병변이 우세하고 면역 염증의 뚜렷한 징후가있을뿐만 아니라 질병의 전신 증상이있는 경우 코르티코 스테로이드의 사용이 표시됩니다. 사용 효과는 치료 시작 후 처음 8주 동안 나타납니다. 프레드니솔론은 다음 계획에 따라 처방됩니다. 악화의 높이에서 하루 60mg, 그 다음 복용량을 점차적으로 줄이고 6-10주차까지 하루 5-10mg의 유지 용량으로 조정합니다. 임상 관해에 도달하면 약물을 점차적으로 취소합니다. 관해가 이루어지지 않으면 52주까지 외래 환자를 대상으로 프레드니솔론 치료를 계속합니다. 질병의 심한 과정에서 현재의 직장 질, 피부 - 장, 장내 누공의 형태로 합병증이있는 경우 6-mercaptopurine을 하루에 0,05-2 번 3g으로 10 일 코스로 지정합니다. 임상적 관해에 도달할 때까지 3일 간격. 그 후, 그들은 그 해 동안 약물의 유지 용량을 복용하는 것으로 전환합니다. 이 경우 6-머캅토퓨린의 용량은 75일 3mg입니다. 면역 억제제 치료의 효과는 4-XNUMX 개월 후에 결정할 수 있습니다. 크론병 치료에 광범위하게 사용되는 메트로니다졸은 항문주위 누공 및 열창, 살라조제제 및 글루코코르티코이드의 효과 부족, 직장 절제술 후 질병의 재발을 주요 적응증으로 하는 것으로 나타났습니다. 이 약은 하루에 500-1000mg의 용량으로 처방됩니다. 연속 과정의 기간은 4주를 초과해서는 안 됩니다. 크론 병의 증상 치료는 지사제 (imodium, loperamide)의 짧은 코스 (각각 2-3 일)의 임명으로 축소됩니다. 용량은 임상 효과에 따라 개별적으로 선택됩니다. 지사제를 장기간(5일 이상) 처방하지 마십시오. 크론병에서 흡수장애 증후군이 존재하기 때문에 담즙산을 포함하지 않는 효소 제제(판크레아틴, 메심포르테, 솔리짐, 소밀라제)는 매 식사와 함께 2-6정의 용량으로 사용됩니다. 적응증에 따르면 빈혈과 저알부민혈증은 철 제제(비경구)를 처방하고 알베진, 단백질 가수분해제, 아미노펩티드, 아미노혈액을 투여함으로써 교정된다. 알약에 종합 비타민을 할당하고 캡슐에 Essentiale를 할당하십시오. dysbacteriosis의 치료는 일반적인 규칙에 따라 수행됩니다. 예후 및 예방. 크론병의 경우 시기적절한 진단과 효과적인 추적 관찰을 통해 삶의 예후는 유리하지만 업무에 있어서는 불확실합니다. 중증 질환 환자의 경우 합병증 및 전신 증상이 나타나면 장애 그룹 I 또는 II가 설정됩니다. 크론병은 전암성 질환입니다. 환자는 질병 경과의 특징을 자세히 숙지하고 가능한 합병증에 대해 경고하고 임상 증상을 접근 가능한 형태로 설명해야합니다. 강의 14. 소화관의 질병. 결장의 질병. 비특이적 궤양성 대장염 비특이적 궤양성 대장염은 궤양성-파괴적 변화로 결장의 점막에 영향을 미치는 염증성 질환으로, 만성 재발 과정을 가지며 종종 생명을 위협하는 합병증의 발병을 동반합니다. 병인학 및 병인. 비특이적 궤양성 대장염은 특발성 질환입니다. 발생 이유는 알려져 있지 않습니다. 질병의 기원을 설명하는 많은 이론(전염성, 효소성, 알레르기성, 면역성, 신경성 등) 중에서 감염성 이론이 가장 중요하지만 결장 내용물에서 병원체를 분리하려는 시도는 실패했습니다. 만성 궤양성 대장염의 병리학적 과정은 직장에서 시작하여 근위 방향으로 퍼져 결장의 위에 있는 부분을 포착합니다. 염증은 직장(직장염), 직장 및 S상 결장염(직장 결장염)으로 제한되거나 왼쪽 부분 전체로 퍼지거나(좌측 대장염) 전체 결장에 영향을 미칠 수 있습니다(전체 대장염). 기능적 측면에서 비특이적 대장염에서 결장의 길이는 약 1/3로 줄어듭니다. 병리학 적 물질에 대한 연구에서 결장 점막의 확산 염증이 나타났습니다 (발음 부종 및 과다, 주름이 두꺼워짐). 다양한 크기의 궤양이 점막에 형성되며, 그 바닥은 점막에 위치하며 점막하층, 근육 및 장막에 덜 자주 위치하는 불규칙한 모양을 가집니다. 형태 학적으로 초기 기간에 다형 핵 백혈구가 혼합 된 림프구, 혈관 확장 및 이러한 혈관의 내피 부종으로 구성된 점막 고유 층의 침윤이 결정됩니다. 미세 순환의 위반은 점막 상피의 구조와 기능의 위반을 악화시키는 저산소증의 발병을 동반합니다. 뚜렷한 임상 증상의 단계는 호중구의 축적이 음와의 내강에 발생하는 음낭염의 발달, 상피 표층의 백혈구 침윤을 동반합니다. 토굴의 원위 부분이 제거되고 토굴 농양이 나타나며, 그 형성은 상피 세포의 손상된 성숙에 의해 중요한 역할을합니다. 음와 안감 상피의 괴사로 음와 농양이 열리고 궤양이 형성됩니다. 차도 기간 동안 점막은 회복되지만 위축, 선와 변형 및 고유 층의 고르지 않은 두꺼워짐이 남아 있습니다. 분류 (Yu. V. Baltaitis et al., 1986). 임상 특성. 1. 임상 형태: 1) 급성; 2) 만성. 2. 현재: 1) 빠르게 진행 중입니다. 2) 지속적으로 재발; 3) 재발성; 4) 잠재. 3. 활동 정도: 1) 악화; 2) 퇴색 악화; 3) 완화. 4. 심각도: 1) 빛; 2) 보통; 3) 무겁다. 해부학 적 특성. 1. 거시적 특성: 1) 직장염: 2) 직장결장염; 3) 부분적 병변; 4) 완전한 패배. 2. 미세한 특성: 1) 파괴적인 염증 과정의 우세; 2) 배상 요소로 염증 과정의 감소; 3) 염증 과정의 결과 합병증. 1. 지역: 1) 장 출혈; 2) 결장의 천공; 3) 결장의 협착; 4) 가성용종증; 5) XNUMX차 장 감염; 6) 점막의 소실; 7) 결장의 독성 팽창; 8) 악성. 2. 일반: 1) 기능적 피질기능저하증; 2) 패혈증; 3) 전신 증상 - 관절염, 천장관절염, 피부 병변, 홍채염, 아밀로이드증, 정맥염, 경화성 담관염, 간 이영양증. 임상 사진. 궤양성 대장염의 임상 양상은 다형성이며 과정의 중증도와 과정의 중증도에 따라 다릅니다. 종종 만성으로 간주되는 염증 과정의 과정은 어떤 경우에는 급성으로 진행됩니다. 결장의 손상 정도도 다양할 수 있습니다. 비특이성 궤양성 대장염은 배변 중 성홍혈 분비물, 장 기능 장애, 복통의 3가지 주요 증상이 특징입니다. 배변 중 혈액 분리(대변 표면의 줄무늬에서 300ml 이상까지)는 질병의 첫 번째 징후입니다. 급성 형태의 질병에서는 제트기에 의해 혈액이 분비되어 붕괴 및 출혈성 쇼크가 발생할 때까지 혈압이 감소합니다. 장 기능 장애는 반복되는 불안정한 대변에 대한 불만의 형태로 나타납니다. 이는 점막에 대한 광범위한 손상과 물과 염분 흡수 감소의 결과입니다. 대부분의 경우 설사는 심한 궤양성 대장염과 함께 발생합니다. 그러나 설사는 과정의 심각성을 나타내는 신뢰할 수 있는 지표가 아닙니다. 대변에 적혈구가 존재하는 것과 함께 설사의 중증도가 중요합니다. 궤양성 대장염이 있는 상당수의 환자에서 혈액과 점액이 형성된 대변 표면에서 주기적으로 발견되며, 이는 종종 치질의 징후로 잘못 간주됩니다. 환자는 하복부에 경련 또는 지속적인 성질의 통증을 호소하며, 이는 하복부 또는 왼쪽 장골 부위에 더 자주 국한되며 배변 행위 전에 증가하고 배변 후에 사라집니다. Tenesmus는 종종 언급됩니다. 장의 점막하층, 근육층 및 장액층이 이 과정에 관여하면 통증이 증가합니다. 복부의 촉진은 전 복벽 근육의 방어로 나타납니다. 비특이적 궤양성 대장염의 경미한 경과는 환자의 만족스러운 상태를 특징으로 합니다. 복부 통증은 중등도이며 단기적입니다. 의자는 하루에 최대 2-3 번 장식되고 속도가 빨라집니다. 대변에서 혈액과 점액이 발견됩니다. 이 과정은 직장과 S상 결장 내에 국한됩니다. 임상 과정은 반복적입니다. salazopreparations으로 치료의 효과는 만족스럽습니다. 재발은 일년에 2 번 이상 발생하지 않습니다. 완화는 길 수 있습니다(2-3년 이상). 환자에게 설사가 있으면 질병의 중등도 과정이 진단됩니다. 의자는 자주 (하루에 최대 6-8 번), 각 부분에서 혈액과 점액의 혼합물이 보입니다. 복부의 경련성 통증이 더 강렬합니다. 체온이 최대 38 ° C까지 상승하는 간헐적 인 발열, 강렬한 전반적인 약점이 있습니다. 질병의 장외 증상(관절염, 포도막염, 결절 홍반)도 있을 수 있습니다. 과정은 지속적으로 반복되고, salazopreparations의 효과는 불안정하고, 호르몬은 악화 중에 처방됩니다. 심각한 형태의 질병은 급성 발병이 특징입니다. 대장의 전체 병변은 병리학 적 과정이 장벽 깊숙이 퍼짐에 따라 빠르게 발전합니다. 환자의 상태가 급격히 악화됩니다. 클리닉은 갑작스런 발병, 고열, 하루 최대 24번의 심한 설사, 심한 장출혈, 급격한 탈수 증가가 특징입니다. 빈맥이 나타나고 혈압이 감소하며 비특이적 궤양성 대장염의 장외 증상이 증가합니다. 보존적 치료가 항상 효과적인 것은 아니며 응급 수술이 필요한 경우가 많습니다. 진단 및 감별진단. 경미한 형태의 질병에 대한 임상 혈액 검사에서 약간의 호중구 백혈구 증가증, ESR 증가 및 적혈구 수치는 변하지 않습니다. 경과의 중증도가 증가하고 악화 기간이 길어짐에 따라 혼합 기원 빈혈이 발생합니다 (B12-결핍 및 철 결핍), ESR 증가. 중등도 및 중증 형태의 혈액에 대한 생화학적 분석에서 단백질 이상혈증, 저알부민혈증, 고감마글로불린혈증, 전해질 불균형 및 산-염기 상태가 주목됩니다. 소변의 일반적인 분석에서 아밀로이드증의 배경에 대해 신 증후군의 형태로 합병증이 발생할 때만 변화가 나타납니다. 소변 검사에 특징적인 변화가있을 때 - 단백뇨, "죽은"요도 침전물, 혈액의 증가도 있습니다 및 크레아티닌, 요소의 수준. 진단의 주요 역할은 비특이적 궤양 성 대장염에서 결장 점막이 주로 영향을 받기 때문에 표적 생검을 통한 내시경 검사에 의해 획득됩니다. 직장은 항상 병리학 적 과정에 관여합니다. 즉, S 상 결장경 검사 중 항문 괄약근 바로 뒤에서 내시경 검사 중에 미란성 및 궤양 성 변화가 감지됩니다. 궤양성 대장염의 경우 심한 경련으로 인해 직장상 결장 굴곡을 항상 극복할 수 있는 것은 아닙니다. 직장경의 관을 잡으려는 시도에는 심한 통증이 동반됩니다. 이 상황에서 직장경은 12-15cm 이하의 깊이까지 삽입해야 합니다. 비특이성 궤양성 대장염이 심하게 악화되는 동안 대장 내시경을 시행하는 것은 안전하지 않습니다. 악성 위험이 높은 경우에 사용해야 합니다. S자 결장경 검사의 높은 정보 내용에 주목해야 합니다. 내시경 사진은 질병의 형태에 따라 다릅니다. 경미한 형태의 부종성 둔한 점막, 장 벽에 두꺼운 희끄무레한 점액 오버레이 및 약간의 접촉 출혈이 보입니다. 점막하층의 혈관 패턴은 육안으로 확인되지 않습니다. 질병의 중등도 과정에서 점막의 충혈 및 부종, 심한 접촉 출혈, 출혈, 미란 및 불규칙한 모양의 궤양, 장의 벽에 두꺼운 점액 오버레이가 나타납니다. 질병의 심한 과정에서 결장의 점막이 상당 부분 파괴됩니다. 과립형의 출혈성 내부 표면, 섬유소 침착물이 있는 광범위한 궤양 부위, 다양한 크기와 모양의 가용종, 장 내강의 고름 및 혈액이 발견됩니다. 대장 내시경 및 S 상 결장 내시경 검사에 대한 금기는 질병의 급성기에 궤양 성 대장염의 심각한 형태입니다. X선 검사를 통해 병변의 범위를 결정할 수 있습니다. 내시경 데이터가 불충분할 경우 진단을 명확히 하십시오. 크론병, 게실 질환, 허혈성 대장염과의 감별 진단; 적시에 악성 징후를 감지합니다. 단순 방사선 사진은 천공 중 횡격막 돔 아래의 장의 단축, 피로 부족, 독성 팽창, 자유 가스를 나타낼 수 있습니다. Irrigoscopy는 세심한 주의를 기울여 수행해야 합니다. 환자의 상태를 악화시킬 수 있습니다. 어떤 경우에는 관장제와 완하제로 바륨 관장 환자를 준비하는 것이 연구 2 일 전에 처방 된 특별식이 요법으로 대체되어야합니다. 어떤 경우에는 조영제의 사용이 천공을 가속화하거나 결장의 독성 팽창을 유발할 수 있습니다. 따라서 irrigoscopy는 급성 현상이 진정 된 후에 수행됩니다. 이 방법은 점막의 불균일 및 "입자", 장벽의 두꺼워짐, 궤양, 가성 용종증, 피로 부족을 나타냅니다. 비특이적 궤양성 대장염의 감별 진단은 주로 급성 장 감염으로 수행됩니다. 장 감염의 전염병이 있는 경우 진단이 쉽게 확립됩니다. 그러나 급성 장염에서 산발성 이환의 경우에도 대장염 증후군은 재발 없이 흐르고 궤양성 대장염은 재발 과정을 갖는다. 급성 장 감염을 식별하는 가장 정확한 방법에는 세균학적 및 혈청학적 방법이 있습니다. 종종 궤양성 대장염은 크론병과 구별됩니다. 전형적인 경우 크론병은 직장 손상이 없고 회장이 병리학적 과정에 자주 관여하며 장벽의 분절 병변이 있다는 점에서 비특이적 대장염과 다릅니다. 최종 진단은 생검 표본에서 크론병에 특이적인 림프육아종을 검출함으로써 이루어질 수 있습니다. 육아종성 대장염의 경우, 직장주위염과 직장주위 누공이 비특이적 궤양성 대장염보다 더 자주 발견됩니다. 어떤 경우에는 궤양성 대장염과 장결핵을 구별해야 합니다. 장 결핵의 경우 과정의 특정 국소화가 특징적입니다 (회장, 회맹 부위), 분절 장 손상. 그러나 때때로 장 결핵의 경우 직장과 대장 전체가 영향을 받습니다. 장 결핵의 대장 내시경 사진은 칙칙한 내용물로 채워진 융기 된 가장자리가있는 궤양의 존재가 특징입니다. 결핵성 궤양은 횡방향으로 퍼지는 경향이 있으며 궤양이 다시 나타나는 짧은 흉터를 남깁니다. 비특이적 궤양성 대장염의 경우 이전 궤양 부위에 흉터가 형성되지 않습니다. 노인 및 노인 환자에서 궤양성 대장염은 허혈성 대장염과 감별되어야 합니다. 후자는 식후 20~30분에 복부에 격렬한 발작성 통증이 나타나는 반면 궤양성 대장염에서는 배변 전에 통증이 발생합니다. 가장 중요한 방사선학적 징후는 "지문" 증상입니다. 허혈성 대장염의 내시경 사진은 병변의 경계, 점막하 출혈, 장내강으로 돌출된 청색증 가성용종 형성이 특징입니다. 조직학적 검사는 헤모시데린 함유 세포와 섬유증을 나타냅니다. 생검 당시 접촉 출혈의 부재는 또한 허혈성 대장염을 더 잘 나타냅니다. 치료. 비특이성 궤양성 대장염은 단일 병인 인자가 없고 발병 기전의 복잡성으로 인해 이 질병의 치료가 어렵습니다. 항염증 및 항균 효과가 있는 약물이 사용됩니다: salazopyridazine, sulfasalazine, salazodimethoxin, salofalk. 장내 미생물의 참여로 경구 복용된 설파살라진은 5-아미노살리실산과 설파피리딘으로 분해됩니다. 흡수되지 않은 설파피리딘은 클로스트리듐과 박테리오드를 포함한 장내 혐기성 미생물의 성장을 억제합니다. 그리고 5-아미노살리실산 덕분에 이 약물은 장내 미생물의 변화를 일으킬 뿐만 아니라 면역 반응을 조절하고 염증 과정의 매개체를 차단합니다. 이 약물은 활성 염증의 전체 기간 동안 하루 2-6g의 용량으로 처방됩니다. 대장염 증후군이 가라앉으면 설파살라진의 복용량을 점진적으로 줄여서 유지합니다(하루 평균 1~1,5정). 5-아미노살리실산 유도체(salofalk, mesacol, salosan, tidikol)의 지정은 기본 방법이며 경도 및 중등도 형태의 궤양성 대장염에 단독 요법으로 사용할 수 있습니다. 치료는 식단에 단백질, 지방, 탄수화물 및 비타민의 균형 잡힌 함량이 있는 상태에서 유제품을 제외하고 식이 요법의 배경에 대해 수행됩니다. 신선한 과일, 야채, 통조림 식품은 제외하는 것이 좋습니다. 음식은 기계적, 화학적으로 부드러워야 합니다. 하루에 4-5번 분수식을 먹입니다. 비타민 불균형은 미량 원소의 흡수 과정을 방해하고 정제 ( "Duovit", "Oligovit", "Unicap")의 복합 제제 지정으로 보상됩니다. 경증 및 중등도 질환이 있는 개인의 중증 설사 증후군의 경우 위장관 호르몬 및 생체 아민(혈관 활성 장 펩타이드, 가스트린, 세로토닌)의 합성을 억제하는 산도스타틴이 표시되며, 그 생성은 궤양성 대장염 및 크론병에서 급격히 증가합니다. 또한 이 약물은 분비를 감소시키고 장의 흡수를 개선하고 내장 혈류를 억제하며 운동성을 감소시킵니다. 산도 스타틴 (7 mg 0,1 회 피하 투여시 2 일 이내)을 사용하면 설사가 감소하고 테네스 무스가 실질적으로 사라지고 대변과 함께 혈액 배설이 감소합니다. 심한 형태의 비특이적 궤양 성 대장염에서는 비경 구 영양을 배경으로 치료가 수행됩니다. 이러한 제제의 단백질 함량은 체중 kg당 약 1,5-2,0g이어야 합니다. 비경구적으로 투여되는 코르티코스테로이드는 심각한 형태의 질병에 대한 병리학적 치료제입니다. 첫날에는 프레드니솔론을 12시간 간격(90-120mg 이상)으로 정맥 주사하고 다음 5일 동안은 근육 주사합니다. 점차적으로 복용량을 줄입니다. 긍정적 인 효과로 경구 약물 (prednisolone 40mg / day)로 전환합니다. 안정 관해 기간 동안 호르몬을 장기간 투여하는 것은 비현실적입니다. 질병의 심각한 경과를 가진 환자에서 고압산소화(HBO)의 긍정적인 효과가 나타났습니다. 관해 기간 동안 HBO 과정(7-10 절차)을 사용하면 재발 빈도를 줄일 수 있습니다. 응급 수술의 적응증: 장 천공, 독성 팽창, 다량의 장 출혈, 악성 종양. 비특이적 궤양 성 궤양의 중등도 형태에서는 섬유질, 유제품 및 높은 단백질 함량을 제한하는 엄격한식이 요법이 필요합니다. 프레드니솔론은 하루 20-40mg의 초기 용량으로 경구 투여됩니다. 치료는 sulfasalazine 및 그 유사체로 보완될 수 있으며, 경구로 복용하거나 직장에 미세 결정체 및 좌약을 투여합니다. 설파살라진의 초기 용량은 1일 4g이며, 그 후 6-XNUMXg으로 증량합니다. 보조 치료 방법으로 항염증제 및 지혈 효과가있는 허브의 달인 (버넷 뿌리, 쐐기풀 잎, 이끼, 회색 알더 콘, 감초 뿌리)를 사용할 수 있으며, 한약은 종종 살라조 제제의 복용량을 줄이고 연장 할 수 있습니다 용서. 예후 및 예방. 심한 경우와 전신 및 국소 합병증이 있는 경우 예후는 심각합니다. 환자들은 완전히 일을 할 수 없습니다. 경증 및 중등도 형태의 질병에서는 삶의 예후가 유리합니다. 환자는 가벼운 작업으로 전환되어야 합니다. 관해 기간 동안 살라조 제제, 세균 제제, 정신 요법 및 식이 요법을 통한 유지 치료가 권장됩니다. 장기간(5~7년 이상) 비특이적 궤양성 대장염을 앓는 환자는 대장암 발생 위험군으로 분류하고 진료기록부를 작성해야 한다. 이 환자들은 표적 생검을 통해 1년에 한 번 대장 내시경 검사를 받습니다. 강의 15번. 신장 질환. 급성 사구체신염 급성 사구체신염(AGN)은 사구체에 국한된 전염성 알레르기 성질의 급성 미만성 신장 질환입니다. AGN은 독립적인 질병(일차)이거나 다른 질병의 일부로 이차적일 수 있어 후자의 임상 양상과 진단을 복잡하게 만듭니다. AGN은 일반적으로 젊고 중년 남성에게 영향을 미칩니다. 병인학. AGN은 구균 감염(인플루엔자, 급성 편도선염, 소위 신원성 미생물에 의한 인두염) 후에 가장 자주 발생합니다. 환자의 60-80%에서 A군 β-용혈성 연쇄상구균이 발견되며, 1/3에서는 AGN의 병인을 규명할 수 없습니다. 장기간의 저체온증, 특히 습도가 높은 조건은 AGN의 발병에 기여합니다. 예방 접종도 질병의 발병 요인이며 75%의 경우 두 번째 또는 세 번째 주사 후에 신장이 영향을 받습니다. 병인. 질병의 발병기전에는 면역 메커니즘이 있습니다. 항원(연쇄구균, 약용, 외래 단백질)이 신체에 들어가면 이에 반응하여 항체가 형성되어 이러한 항원과 결합하고 보체의 3번째 분획과 함께 혈관을 순환하는 면역 복합체를 형성합니다. 침대. 복합체는 사구체 모세혈관의 기저막 외부에 침착되어 보체 분해 산물의 방출을 통해 손상을 일으킬 수 있으며, 이는 모세혈관의 투과성을 증가시키고 후자의 국소적 변화를 유발합니다. 호중구는 리소좀 효소가 내피와 기저막의 손상을 악화시켜 서로 분리시키는 면역 복합체 침착 부위로 돌진합니다. 혈소판 탈과립은 세로토닌의 방출을 유발하여 기저막에 혈액 응고 및 섬유소 침착을 유발합니다. 신체에서 면역 복합체의 제거는 메산지움 및 내피 세포의 증식 형태로 대식세포 반응에 의해 촉진되며, 이 과정의 효과로 회복이 발생합니다. 임상 사진. 질병의 임상상은 다음과 같은 증후군으로 구성됩니다. 요로 증후군. 1. 면역 복합체가 침착되는 동안 형성된 사구체의 모세 혈관 벽 공간을 통한 단백질 분자의 통과로 인한 단백뇨. 단백뇨는 본질적으로 선택적이며 주로 알부민이 사구체 "필터"를 통과합니다. 2. 모세혈관 사이질 및 간질 조직의 병리학적 과정에 관여하여 혈뇨. 적혈구는 기저막의 가장 작은 틈을 관통하여 모양을 바꿉니다. 3. Cylindruria - 세뇨관의 원통형 세포의 소변 배설. 신장 상피의 붕괴 된 세포의 세뇨관에서 영양 장애 과정 동안 조밀 한 과립 덩어리로 구성된 과립 실린더가 형성됩니다. 왁스 같은 실린더는 날카로운 윤곽과 균질한 구조를 가지고 있습니다. 유리질 캐스트는 단백질 형성입니다. 고혈압 증후군은 다음으로 인해 관찰됩니다. 1) 나트륨 및 수분 보유; 2) 레닌-안지오텐신-알도스테론 및 교감부신계의 활성화; 3) 신장의 억제 시스템의 기능 감소. 부종 증후군은 다음 요인과 관련이 있습니다. 1) 패배로 인한 사구체 여과의 감소; 2) 나트륨의 여과 전하 감소 및 재흡수 증가; 3) 체내 나트륨 저류로 인한 수분 저류; 4) 숨은 참조의 증가; 5) 속발성 고알도스테론증; 6) ADH의 분비가 증가하고 이에 대한 원위 네프론의 민감도가 증가하여 체액 저류가 발생합니다. 7) 모세관 벽의 투과성 증가 및 조직으로의 혈장 방출; 8) 다량의 단백뇨로 인한 혈장 종양압 감소. AGN에 제시된 불만은 특이적이지 않으며 다양한 질병에서 발생합니다. 기억 상실증에서 최근의 인후통, 만성 편도선염의 악화, 저체온증 등을 나타내는 것이 매우 중요합니다. 일부 환자는 아침에 얼굴의 약간의 부기(페이스트)와 함께 소변량의 감소를 주목합니다. 질병의 첫 번째 날에 1/3-3/4 환자의 경우 신장 크기의 증가와 관련된 요추 부위의 통증이 매우 강하지 않습니다. 또한 피로감, 두통, 육체 노동 중 숨가쁨, 체온이 아열성으로 단기 상승합니다. 환자의 절반에서만 발견되는 동맥성 고혈압은 140-160 / 85-90 mmHg로 숫자가 증가하는 것이 특징입니다. 미술. (드물게 - 최대 180/100 mm Hg. Art.). 진단. 100% 사례에서 소변 검사를 통해 다양한 중증도의 단백뇨, 원통형뇨증, 그리고 진단에 가장 중요한 것은 미세혈뇨(시야에서 최대 10개의 적혈구)부터 거대혈뇨(아주 드물기는 하지만)까지 다양한 중증도의 혈뇨가 나타납니다. ). 그러나 AGN이 의심되는 경우에는 소변 단 한 부분에서도 적혈구가 검출되지 않을 수 있으므로 일련의 반복적인 소변 검사나 네치포렌코 검사(1μl에서 생성된 원소의 수 측정)를 시행하는 것이 필요합니다. 혈액을 검사 할 때 급성기 지표가 감지됩니다 (피브리노겐 및 α 함량 증가2-글로불린, C-반응성 단백질, ESR 가속), 백혈구 수의 변화가 적고 중등도의 빈혈. AGN의 복잡하지 않은 과정으로 혈액 내 질소 물질(크레아티닌, 인디칸, 요소)의 함량은 변하지 않습니다. 질병의 초기 단계에서 Reberg 테스트의 변화가 관찰됩니다. 즉, 사구체 여과의 감소와 세뇨관 재흡수의 증가가 회복되어 정상화됩니다. 심한 동맥성 고혈압 환자의 엑스레이 검사는 환자가 회복되는 것과 같은 크기를 차지하는 좌심실의 적당한 증가를 보일 수 있습니다. AGN에는 3가지 임상 변이가 있습니다. 1) 단증상 변이: 경미한 불만, 부종 및 동맥성 고혈압의 부재, 요로 증후군만 있음; 질병 경과의 가장 흔한 변종(사례의 86%). 2) 신변형: 부종, 핍뇨가 뚜렷하고 혈압을 비교적 낮은 수치로 올릴 수 있으며 환자의 8%에서 발견된다. 3) 확장 버전: 동맥성 고혈압, 높은 수치(180/100mmHg)에 도달, 중등도의 부종, 순환 부전이 사례의 6%에서 발생합니다. 차동 진단. AGN은 만성 사구체신염과 구별되어야 하며, 이는 AGN의 급성 발병과 그에 따른 증상의 완전한 역전으로 어렵지 않습니다. 그러나 급성 발병이 없고 질병의 특정 징후가 장기간 지속되는 경우 진단은 훨씬 더 복잡해집니다. 분화가 어려운 경우 신장 천자 생검을 실시합니다. AGN과 신우신염은 두 질병 모두에서 백혈구 증가증이 있기 때문에 감별하기 어렵습니다. 그러나 AGN은 더 많은 단백뇨와 어떤 경우에는 부종을 동반합니다. 감별 진단은 또한 발열 및 배뇨 장애를 동반하는 허리에 더 두드러진 통증의 형태로 신우신염의 임상 증상에 의해 도움이 됩니다. 또한 진단적 가치는 신우신염에서 세균뇨의 결정, "활성" 백혈구의 식별, x-선(컵 변형) 및 동위원소-레노그래피(신장 기능의 비대칭) 연구입니다. AGN은 독립된 질환으로 AGN이 질병의 징후 중 하나인 만성 미만성 결합 조직 질환과 구별되어야 합니다. 이 상황은 일반적으로 요로, 고혈압 및 부종 증후군의 중증도와 질병의 다른 증상의 명확성이 불충분할 때 발생하며, SLE(전신성 홍반성 루푸스)에서 더 자주 발생합니다. SLE의 정확한 진단은 관절 증후군, 피부 및 기타 기관(심장) 손상, 현저한 면역학적 변화(고역가의 항기관 항체 검출, 홍반성 루푸스 세포, DNA 및 RNA에 대한 항체 검출)를 고려하여 이루어질 수 있습니다. )뿐만 아니라 임상 사진의 역학을 모니터링합니다. 치료. AGN 치료는 복잡하며 다음 조치를 포함합니다. 1. 모드. AGN이 의심되거나 진단이 확정된 직후에 환자를 즉시 입원시켜야 합니다. 부종이 사라지고 혈압이 정상화될 때까지 약 2-4주간은 엄격한 침상 안정을 취해야 합니다. 침대에 누워 있으면 몸이 고르게 따뜻해져서 혈관 경련이 감소하고(따라서 혈압이 감소함) 사구체 여과 및 이뇨가 증가합니다. 퇴원 후 질병 발병일로부터 최대 4 개월 동안 가정 치료가 표시되며 이는 AGN이 만성 단계로 전환되는 것을 예방하는 최선의 방법입니다. 2. 다이어트. 임상 증상의 중증도에 따라 수분과 염화나트륨을 제한하는 것이 매우 중요합니다. 확장 된 신 형태의 경우 이뇨제와 동일한 양의 수분 섭취로 1-2 일 동안 완전한 금식이 권장됩니다. 2~3일째에는 칼륨염이 풍부한 음식(죽, 감자) 섭취를 보여준다. 하루에 마신 물의 총량은 전날 할당된 소변의 양에 300-500ml를 더한 것과 같아야 합니다. 3-4 일 후 환자는 단백질 제한식이 요법 (60 일 최대 3g)으로 옮겨지며 총 소금량은 5-XNUMXg / 일 이하입니다. 이러한식이 요법은 모든 신장 외 증상이 사라지고 요로 침전물이 급격히 개선 될 때까지 권장됩니다. 3. 약물 요법에는 주로 항생제 요법이 포함되지만 AGN의 감염 특성이 확실하게 확립된 경우(병원체가 분리되고 발병 후 3주 이내)에만 수행되어야 합니다. 일반적으로 기존 용량의 페니실린 또는 반합성 유사체를 처방합니다. 만성 감염(편도선염, 부비동염 등)의 명백한 병소의 존재도 항생제 치료의 직접적인 징후입니다. AGN 치료의 이뇨제는 체액 저류, 혈압 상승 및 심부전의 출현으로 만 표시됩니다. 가장 효과적인 푸로세미드(40-80 mg), 부종 및 고혈압이 제거될 때까지 사용됩니다. 이 약의 장기 처방이 필요하지 않으며 3-4 회 복용으로 충분합니다. 부종이 없지만 지속적인 고혈압 또는 saluretics의 항 고혈압 효과가 불충분 한 경우 항 고혈압제 (clophelin, dopegyt)는 동맥성 고혈압의 지속성에 따라 투여 기간으로 처방됩니다. AGN의 신 형태에서는 면역 억제 요법이 처방됩니다(코르티코스테로이드 - 하루 60-120mg의 프레드니솔론, 그 후 점진적인 용량 감소, 4-8주 동안의 사용 기간). 부종이 심하고 이뇨량이 현저히 감소된 AGN의 경우 헤파린을 20-000주 동안 하루 30-000IU로 투여하여 혈액 응고 시간을 4-6배 증가시킨다. 연장 된 단백뇨의 경우 indomethacin 또는 voltaren은 하루 75-150mg으로 처방됩니다 (고혈압 및 핍뇨가없는 경우). 예후는 유리하지만 장기간 형태로 진행되면 과정이 만성화 될 가능성이 있습니다. AGN의 예방은 국소 감염의 효과적인 치료, 합리적인 경화에 달려 있습니다. 예방 접종 후 질병의 발병을 적시에 감지하기 위해 모든 환자에서 SARS를 옮기려면 소변을 검사해야합니다. 강의 16. 신장 질환. 신우신염 신우신염은 신우, 그 꽃받침 및 신장의 물질이 과정에 관여하는 감염성 질환으로, 간질 조직의 병변이 우세합니다. 이와 관련하여 신우 신염은 간질 (간질) 신염입니다. 이것은 신우신염보다 더 넓은 개념입니다. 첫째, 간질의 주요 관여와 함께 모든 병인의 신장 염증 유형, 둘째,이 염증이 유일한 주요 발현 인 특수 질병을 나타냅니다. 간질성 신염에 가까운 것은 소위 세뇨관-간질성 신염이며, 여기에는 세뇨관과 신장 간질의 우호적인 병변이 있습니다. 분류. 임상 및 형태학적 데이터에 기초하여 급성 및 만성 신우신염이 구별되며, 이는 일반적으로 급성 신우신염의 공격 형태로 재발하는 과정을 갖습니다. 또한 신우 신염은 일면 및 양면 일 수 있습니다. 코스의 형태에 따라 (만성 신우 신염의 경우) : 재발 성, 잠복성 만성 신우 신염, 신우 신염 주름진 신장. 병인학 및 병인. 신우신염은 전염병입니다. 원인 물질은 대장균, 장구균, 포도상 구균 및 기타 박테리아와 같은 비특이적 감염체이지만 대부분의 경우 대장균 (40%) 및 혼합 식물군 (38%)에 대해 이야기합니다. 만성 신우신염을 유발할 수 있는 L형 박테리아, 원형질체(감염을 지지할 수 있는 막이 없는 박테리아의 몸체), 칸디다에 주의를 기울입니다. 감염원은 편도선, 생식기 및 대장 질환일 수 있습니다. 즉, 감염원은 골반을 포함한 신장에 혈류(혈류성 하행성 신우신염)를 침투할 수 있으며, 이는 많은 전염병(장티푸스, 인플루엔자)에서 관찰됩니다. , 협심증, 패혈증). 더 자주 미생물은 요관, 방광, 요도(비뇨기성 상행 신우신염)에서 오름차순 경로를 통해 신장으로 유입되며, 이는 요관 및 골반의 운동 이상증, 증가된 골반내 압력(방심부 및 신우신 역류), 신장 수질의 정맥으로 골반 내용물의 재흡수 ( 신우정맥 역류). 오름차순 신우 신염은 일반적으로 소변 유출이 어려운 비뇨 생식기 질환 (요관의 결석 및 협착, 요도 협착, 비뇨 생식기 계통의 종양)을 복잡하게하므로 임신 중에 종종 발생합니다. 결장과 생식기가 감염의 원인인 경우 신장의 림프성 감염(림프성 신우신염)도 가능합니다. 신우 신염의 발병을 위해서는 신장에 감염이 침투하는 것 외에도 신체의 반응성과 소변 유출 및 요실금을 유발하는 여러 국소 원인이 매우 중요합니다. 같은 이유로 질병의 만성 경과가 재발할 가능성이 있습니다. 요로의 기능적 및 형태적 변화를 가진 감염된 미생물은 요로 정체, 정맥 및 림프 유출 장애로 신장 감염 고정에 기여하고 염증성 침윤의 국소 및 다형성 영역을 유발하고 간질의 고화를 유발합니다. 또는 양쪽 신장. 세관의 간질 조직이 영향을 받은 다음 네프론이 영향을 받습니다. 생산적인 동맥 내막염, 혈관 중간 껍질의 증식, 유리질 현상, 동맥 경화증이 이차적으로 주름진 신장까지 발생합니다. 최근 몇 년 동안 만성 신우 신염의 발병에서 특정 역할이자가 면역 반응에 할당되었습니다. 세균 항원의 영향으로 면역 글로불린 G와 보체가 사구체 모세 혈관의 기저막에 침착되어 손상을 유발합니다. 급성 신우 신염의 만성으로의 전환은 급성 신우 신염의 늦은 진단,시기 적절한 입원, 만성 감염의 존재, 당뇨병, 통풍, 진통제 남용 - 페나세틴에 의해 촉진됩니다. 만성 신우신염은 여성(50%)에서 더 흔하며, 이는 요로 구조와 관련된 어린 시절의 여아에서 임신, 특히 반복된 것(에스트로겐은 요로 평활근의 무력증을 유발함)에 의해 촉진됩니다. , 그들의 변칙. 임상 사진. 위에서 언급했듯이 신우신염의 급성 및 만성 경과가 모두 가능합니다. 질병의 급성기의 임상상은 39-40 ° C까지 체온이 갑자기 급격히 증가하고 약점, 두통, 오한이 시작되고 땀이 많이 나는 것, 메스꺼움 및 구토가 발생할 수 있습니다. 체온의 상승과 함께 요추 부위에 통증이 나타나며 일반적으로 한쪽에 나타납니다. 고통의 본질은 둔하고 강도가 다릅니다. 요로 결석증의 배경에 대한 질병의 발병의 경우 신우 신염의 공격은 신장 산통의 공격에 선행됩니다. 적절한 치료가 없으면 질병이 만성화되거나 환자의 전반적인 상태가 악화되고 급격한 온도 변동으로 임상 적으로 나타나는 신장의 화농성 과정이 발생할 수 있습니다 (35-36 ° 아침에 C에서 저녁에 40-41 ° C까지). 만성 신우 신염은 일반적으로 급성 염증을 제거 할 수 있었지만 신장의 모든 병원체를 근본적으로 파괴하거나 신장에서 소변의 생리적 유출을 회복시키는 것이 불가능했을 때 급성 신우 신염의 치료가 제대로 이루어지지 않은 결과입니다. 만성 신우신염은 습하고 추운 날씨에 악화되는 요추 부위의 지속적인 둔한 통증을 걱정합니다. 또한 만성 신우 신염은 환자가 급성 과정의 모든 징후를 보일 때 주기적으로 악화되는 경향이 있습니다. 진단. 질병 진단의 문제는 신우신염의 증상이 요로 염증으로 인한 다른 질병의 증상과 유사하다는 사실에 기인합니다. 진단 검사 계획에는 혈액 검사, 소변 검사 및 비뇨기 계통의 상태를 보여주는 연구(신장 초음파, X-레이 연구, 감염원에 대한 PCR 분석)가 포함됩니다. 감염원의 종류를 확인하기 위해서는 소변 검체의 세균 배양이 필요하며, 컴퓨터 단층 촬영법을 이용하여 종양 과정을 배제합니다. 따라서 실험실 및 특수 연구 방법은 질병의 인식에 매우 중요합니다. 그리고 만성 신우신염에서 결정적이고 때로는 유일한 징후는 소변, 혈액 및 요로의 변화입니다. 환자의 혈압과 체중을 동적으로 모니터링해야 합니다. 백혈구 증가, ESR 증가, 혈액 내 호중구 이동, 잔류 질소 수준 증가(20-40mg 기준), 요소(40-60mg 기준), 크레아티닌(53-106μmol 기준) / l), 인디칸(표준 1,41, 3,76-180 µmol/l), 콜레스테롤(표준 200-83 mg), 혈액 염화물(표준 XNUMX mmol/l). 소변 변화 진단에 중요: 비중 감소, 단백뇨(일일 포함), 혈뇨 및 원통뇨. 그러나 형성된 소변 침전물 요소의 정량적 측정 방법은 점점 더 진단 중요성을 얻고 있습니다. Kakovsky-Addis (정상 백혈구 최대 4만 개의 적혈구 - 최대 1만 개, 실린더 - 2시간 동안 최대 24개), Amburger (정상 백혈구 최대 2000 , 적혈구 - 최대 1400, 실린더 - 20분당 최대 1), Nechiporenko (일반적으로 백혈구 최대 2500, 적혈구 - 최대 1000, 실린더 - 갓 배출된 소변 20ml에서 최대 1) . 신우신염의 소변 침전물에 있는 적혈구와 백혈구의 절대 수의 비율은 10-20배까지 백혈구의 상당한 우세를 향해 극적으로 변합니다. 만성 신우신염에서 Stenheimer-Malbin 세포가 소변에 나타납니다. 큰 백혈구, 세포질 과립의 브라운 운동, 소변의 삼투압 특성 감소(비중 10-14 미만), 용담 보라색 및 사프로닌으로 파란색 염색, "활성" 백혈구: 원형질의 브라운 운동을 갖는 변경된 백혈구로, 증류수를 첨가하여 1% 메틸렌 블루 수용액으로 염색할 때 나타납니다. "활성" 백혈구 및 Stenheimer-Malbin 세포 수 증가의 진단 값(최대 40%), 세균뇨(소변 100ml당 1개 이상의 미생물 수), 아질산염 검사(미생물 수 이상 100U 이상에서는 미생물이 소변의 아질산염을 분해함)이 강조됨. , sulfanilic acid와 L-naphthylamine을 첨가하면 붉은색이 나타남), 비색 TTX 시험(미생물 탈수소효소의 작용하에 triphenyltetrazolyte chloride가 적색 불용성으로 환원됨) -4 ° C의 온도에서 10-37 시간 이내에 triphenylformazan), 도발적인 프레드니솔론 테스트 (환자는 멸균 접시에 수집하고 소변의 중간 부분은 대조군이며, 30ml의 식염수에 10mg의 프레드니솔론이 있습니다. 천천히 정맥에 주입하고 24시간 후에 XNUMX회씩 시간 간격으로 소변의 중간 부분을 채취합니다. 신장 결핵의 현미경 검사에 특별한주의를 기울여야합니다 (Tsil에 따라 염색 된 얼룩의 현미경 검사, 특수 매체에 소변 파종 - 생물학적 방법 인 Preis 및 Shkolnikova의 방법). 일방적 인 과정이 의심되는 경우 특수 카테터로 각 신장에서 별도로 채취 한 소변 검사를 수행해야합니다. 만성 신우 신염 진단에서 중요한 역할은 방사선 연구 방법에 의해 수행됩니다. 방사선 조사 및 단층 촬영 (신장의 위치, 크기 및 모양 특성화), 배설 및 역행 신우 조영술 (신장 농도 및 배설 능력 감소, 경련 , 기형, 골반 기형, 꽃받침), pneumopyelography (비 조영제 인식 용), 신장 혈관 조영술 (동맥 및 정맥의 혈관 건축학 위반을 나타냄). 기능의 안전성과 신장의 실질, 특히 일방적 인 과정을 결정하기 위해 renography (hippuran iodine 131) 및 scanography (neohydride Hg 203 사용)와 같은 방사선 표시 방법이 사용됩니다. 신우신염의 경우 천자 생검 과정의 초점으로 인해 정보를 제공하지 못할 수 있습니다. Chromocystoscopy는 신장 손상을 나타낼 수 있습니다. 치료. 대부분의 경우 신우신염 치료는 보존적이지만 급성 신우신염이 화농성인 경우 수술적 개입이 필요할 수 있습니다. 보수적 치료는 요법, 식이 요법, 항생제 사용, 신장 기능과 환자 신체 전체를 안정화시키는 다양한 약물로 구성됩니다. 급성 신우신염에서는 엄격한 침상 안정이 필요합니다. 음식은 최적의 단백질, 지방 및 탄수화물을 함유한 식품을 섭취해야 합니다. 급성기에는 단백질과 식물성 식품을 교체해야 합니다. 중독이 심하면 물을 많이 마셔야 합니다. 만성 신우신염의 치료는 원발성 신우신염의 감염(이방성)에 대한 영향과 이차성 신우신염의 한 가지 또는 다른 원인 제거, 병인 기전 및 합병증의 치료로 구성됩니다. 가장 효과적인 치료는 Antibiogram을 결정한 후입니다. 항균제로 지속적인 (최소 2 개월) 치료가 수행됩니다. 입원 즉시 항생제, 설파닐아미드 또는 니트로푸란 약물이 처방됩니다. 1-10 일 후에 약물이 바뀌고 백혈구 뇨증과 세균 뇨가 지속적으로 사라질 때까지 치료가 수행됩니다. 악화가 제거되면 4-5 개월 동안 항균제 중 하나를 사용한 간헐적 치료가 수행됩니다. 약물은 7 일 동안 주어진 다음 8-10 일 동안 휴식을 취하거나 약물을 투여합니다. 10-15일 간격으로 20일 또는 15일 동안 약물을 투여하고 15일 간격을 둔 다음 항균 요법을 다시 처방합니다. 치료 기간 및 간격은 임상 증상 및 실험실 관리에 의해 결정됩니다. 만성 편도선염 환자에서 발생한 신우신염의 경우 페니실린 계열의 항생제가 가장 효과적이며, 남성과 여성의 생식기 감염의 경우 광범위한 항생제가 사용된다는 점을 지적해야 합니다(표 참조). 12). 그람 음성 식물상이 있는 경우 날리딕산으로 치료하면 좋은 결과를 얻을 수 있습니다(흑인, ievigramon - 1,0g 4일 동안 하루 7회, 그러나 그 제제는 다른 약물보다 덜 자주 처방되어야 함(2회)). sulfanilamide 제제에서 etazol (1,0g 4 회 - 10 일), solafur (0,1g 3 회), 지속성 설폰 아미드가 사용됩니다. 또한 코스는 furazolidone, furadonin, furagin (0,1g 하루 4 번)으로 처리됩니다. 치료를 시작하기 전에 신기능을 결정해야 한다는 점을 강조해야 합니다. 장기 항생제 치료는 최소 30ml/min의 사구체 여과율 또는 70mg 이하의 혈청 잔류 질소 함량으로 수행해야 합니다. 치료 일주일 후 약물의 효과를 나타내는 지표는 10ml의 소변에서 미생물 수가 000으로 감소하는 것입니다. 10-14일마다 소변의 반응을 변화시켜 미생물총의 독성을 줄이고 항균제의 효과를 높일 수 있습니다. 알칼리성 식품, 구연산나트륨(10일 XNUMXg), 알칼리성 미네랄 워터는 pH 반응을 줄이는 데 도움이 됩니다. 일부 항균 작용에는 크랜베리와 베어베리에 풍부한 안식향산나트륨(하루 4-6g)이 있습니다. 병원성 치료는 신체의 반응성을 높이고 소변 유출을 개선하며 혈압을 정상화하는 것을 목표로 해야 합니다. 면역 생물학적 반응성을 활성화하기 위해 α- 글로불린,자가 혈액 요법, 수혈, 백신 요법이 사용됩니다 (자가 백신 치료는 30-40 일 동안 피하 0,1 ml 또는 0,2 일마다 0,3-2 ml 수행), 포도상 구균 톡소이드 ( 0,1-0,3- 0,5일마다 0,7-1,0-1,2-1,7-2,0-3 ml). 이뇨제 (베어 베리, 주니퍼 열매, 필드 말꼬리, orthosiphon 잎 - 신장 차, 링곤 베리 잎), 진경제 (papaverine, no-shpa 등)는 소변 유출을 정상화하는 데 도움이됩니다. 소변의 흐름이 막히면 수술적 치료가 필요합니다. 수반되는 고혈압의 경우 isobarine, dopegyt, hemiton, saluretics, aldosterone 길항제와 같은 rauwolfia 제제가 표시됩니다. 예방 및 예후. 신우신염 예방은 XNUMX차 및 XNUMX차 조치로 구성됩니다. XNUMX 차 예방에는 우선 신우 신염의 발병으로 이어질 수있는 질병의 치료가 포함됩니다. 국소 감염, 비뇨기과 질환 (예 : 요로 결석, 전립선 선종 및 소변 유출을 동반하는 모든 질병 신장), 레크리에이션 활동. 표 12 신우신염에 대한 항균제의 비교 효능
이차 예방에는 예방 검사 중 세균 뇨 검출 (예 : 임산부는 적어도 한 달에 한 번 소변의 세균 학적 분석을 수행해야 함), 재발 방지 치료 약속 : 매월 첫 주 - 치료 일시 중지 : 로즈힙 달인, 두 번째, 세 번째 주 - 허브 이뇨제 및 방부제, 네 번째 주 - 항균제(니트로푸란, 항생제, 방부제, 1년에 한 번 - 네비그라몬 1 g 주중 1,0회 및 4g - 두 번째 주 중 또는 2 -NOC 5-100 mg 하루 150회 4-10일). 재발 방지 치료는 2-3 년 동안 수행됩니다. 치료가있는 약국 검사는 3 년에 4-4 번 또는 6-XNUMX 번 수행해야합니다. 예보. 예후는 질병의 단계에 따라 다릅니다. 스파 트리트먼트. 요양소-리조트 치료는 완화 기간 동안 특히 환자가 저 미네랄 워터를 섭취하는 비뇨기과 수술 (Truskavets, Sairme, Zheleznovodsk, Berezovsky 미네랄 워터) 후 이차 결석성 신우 신염 환자의 경우 표시됩니다. 요양소 및 스파 치료는 고혈압, 중증 빈혈 및 명백한 신부전의 경우 금기입니다. 신우신염의 합병증은 다양합니다. 급성 신우 신염에서 화농성 과정의 진행은 큰 농양의 융합과 신장의 덩어리 형성, 화농성 충치와 골반의 소통 (신우 신염), 섬유질 캡슐로의 과정 전환 (신장염 ) 및 말초 조직(신장염). 급성 신우신염은 요실금 상태에서 박테리아의 직접적인 독성 효과의 결과로 발생하는 피라미드 유두의 괴사(유두 괴사)로 인해 복잡해질 수 있습니다. 신우신염의 이러한 합병증은 대부분의 경우 당뇨병 환자에서 발생합니다. 드물게 신우신염이 패혈증의 원인이 됩니다. 반흔 기간 동안 화농성 과정의 제한으로 화농성 막으로 둘러싸인 농양(만성 신장 농양)이 형성될 수 있습니다. 만성 신우신염, 특히 편측성에서는 두 번째(온전한) 신장에서 신인성 고혈압과 동맥경화증이 발생할 수 있습니다. 신장의 양측 신우신염성 주름은 만성 신부전으로 이어집니다. 급성 신우신염의 결과는 일반적으로 회복이지만 합병증(신우신염, 패혈증, 유두 괴사)의 결과로 사망할 수 있습니다. 신장 주름이 있는 만성 신우신염은 종종 질소혈증 요독증으로 끝납니다. 신장 기원의 동맥 고혈압이 발생함에 따라 만성 신우 신염의 치명적인 결과는 때때로 고혈압에서 발생하는 합병증 (뇌출혈, 심근 경색 등)과 관련이 있습니다. 저자: Mostovaya O.S.
세계 최고 높이 천문대 개관
04.05.2024 기류를 이용한 물체 제어
04.05.2024 순종 개는 순종 개보다 더 자주 아프지 않습니다.
03.05.2024
▪ Imagination Catapult RISC-V 프로세서
▪ 기사 삼손 대신 원래 Peterhof 분수를 장식하기로 되어 있던 영웅은 누구였습니까? 자세한 답변 ▪ 기사 램프가 더 이상 깜박이지 않습니다. 무선 전자 및 전기 공학 백과사전 ▪ 기사 스위칭 전원 공급 장치 수리. 램프 대신 커패시터. 무선 전자 및 전기 공학 백과사전
홈페이지 | 도서관 | 조항 | 사이트 맵 | 사이트 리뷰 www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








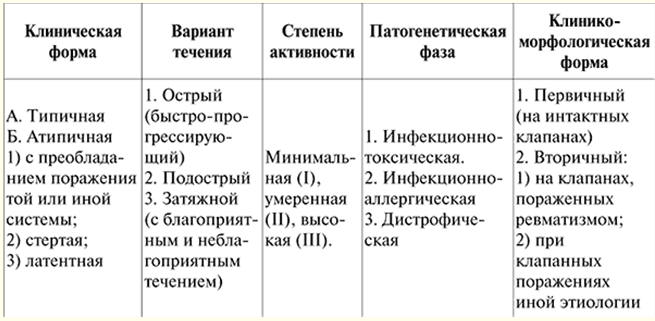








 다른 기사 보기 섹션
다른 기사 보기 섹션 